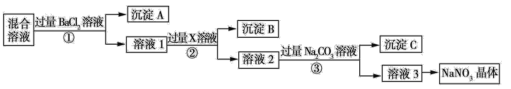
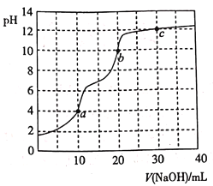
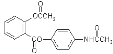
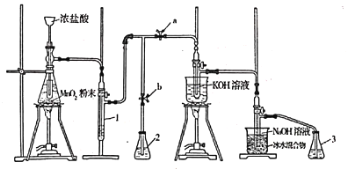
题目内容
【题目】下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4![]() +2H2O
+2H2O
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.实验室用氯化铵和熟石灰制氨:![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
D.Cu与足量的浓硝酸:Cu+2![]() +4H+=Cu2++2NO2↑+2H2O
+4H+=Cu2++2NO2↑+2H2O
【答案】D
【解析】
A.氯化铝溶液中加入过量氨水生成氢氧化铝和氯化铵:Al3++3NH3·H2O=Al(OH)3↓+3![]() ,A错误;
,A错误;
B.氯气溶于水生成盐酸和次氯酸:Cl2+H2O=H++Cl-+HClO,B错误;
C.实验室用氯化铵和熟石灰制氨不属于离子反应,C错误;
D.Cu与足量的浓硝酸反应生成硝酸铜、二氧化氮和水:Cu+2![]() +4H+=Cu2++2NO2↑+2H2O,D正确;
+4H+=Cu2++2NO2↑+2H2O,D正确;
答案选D。

【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(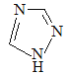 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(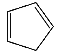 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)