题目内容
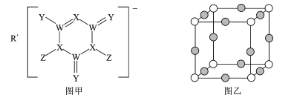
【题目】SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理食品加工公共场所等清洁消毒,结构如图甲所示其中WXYRZ均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期
回答下列问题:
(1)SDIC中,电负性最小的元素是____(填元素名称) ,其中W最外层的孤电子对数为__________。
(2)基态X3-的核外电子排布式为____某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满KLM3个能层,则M的元素符号是___ ,该晶体晶胞结构如图乙所示,则X3-的配位数为____
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中____(填“σ”或“π”)键更稳定
(4)X的最简单氢化物是___ 分子(填“极性”或“非极性”),该分子与1个H+结合形成离子时键角___ (填“变大”“变小”或“不变”),原因是____
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是____
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中已知晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体密度为____g/cm3 (列出计算式)
【答案】钠 0 1s22s22p6 Cu 6 π 极性 变大 NH3中N原子上有一对孤电子对,与H+结合形成NH4+后,原来的孤电子对变为成键电子对,对于其他成键电子对的斥力变小,所以,N-N-H键角变大, 不同元素的电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会释放不同频率的光 ![]()
【解析】
R在化合物中显+1价,且在WXYRZ五种短周期元素中原子序数较大,则R为Na;Z在同周期主族元素中原子半径最小,则Z为Cl;由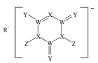 可知,Y易形成2个共价键,且Y的原子序数比R(Na)小,则Y为O;W形成4个共价键且原子序数比Y(O)小,则W为C;W(C)XY(O)的原子序数增大,则X为N;综上所述:WXYRZ分别为C、N、O、Na、Cl,据此解答。
可知,Y易形成2个共价键,且Y的原子序数比R(Na)小,则Y为O;W形成4个共价键且原子序数比Y(O)小,则W为C;W(C)XY(O)的原子序数增大,则X为N;综上所述:WXYRZ分别为C、N、O、Na、Cl,据此解答。
(1)元素的非金属性越强,电负性越大,金属性越强,电负性越小,所以,SDIC中,电负性最小的元素是钠,SDIC中,每个W(C)都形成4对共用电子对,孤电子对数为0,故答案为:钠;0;
(2)X为N,基态X3-(N3-)的核外电子排布式为1s22s22p6,M+核外电子正好充满KLM3个能层,则M+核外有(2+8+18)个=28个电子,M为29号元素Cu,由题意可知,该晶体化学式为Cu3N,晶胞结构中黑色小球代表的原子个数=12×![]() =3,白色小球代表的原子个数=8×
=3,白色小球代表的原子个数=8×![]() =1,即白色小球代表N3-,它的配位离子有上、下、左、右、前、后共6个,故答案为:1s22s22p6;Cu;6;
=1,即白色小球代表N3-,它的配位离子有上、下、左、右、前、后共6个,故答案为:1s22s22p6;Cu;6;
(3)X≡X含两个π键和一个σ键,单键为σ键,由此可见,氮氮键中π键的键能=![]() kJ/mol=347.5kJ/mol>σ键的键能,π键更稳定,故答案为:π;
kJ/mol=347.5kJ/mol>σ键的键能,π键更稳定,故答案为:π;
(4)X为N,其最简单氢化物是NH3,NH3是三角锥形分子,正负电荷中心不重合,为极性分子,NH3与1个H+结合形成离子即NH4+,NH3中N原子上有一对孤电子对,与H+形成NH4+后,原来的孤电子对变为成键电子对,对于其他成键电子对的斥力变小,所以,N-N-H键角变大,故答案为:极性;变大;NH3中N原子上有一对孤电子对,与H+形成NH4+后,原来的孤电子对变为成键电子对,对于其他成键电子对的斥力变小,所以,N-N-H键角变大;
(5)不同元素的电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会释放不同频率的光,因此,SDIC的原子发射光谱中呈现特征颜色,故答案为:不同元素的电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会释放不同频率的光;
(6)R(Na)和Y(O)的单核离子组成的晶体为Na2O,O2-排列方式为面心立方最密堆积,而面心立方最密堆积晶胞中共涉及14个离子,分别位于立方体的8个顶点和6个面心,则一个晶胞中O2-的个数=![]() =4,结合化学式Na2O可知,Na+个数为8,则一个晶胞的质量=
=4,结合化学式Na2O可知,Na+个数为8,则一个晶胞的质量=![]() g,又因为晶胞参数为anm,则一个晶胞的体积=
g,又因为晶胞参数为anm,则一个晶胞的体积=![]() cm3,所以该晶体密度=
cm3,所以该晶体密度=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |

A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
【题目】Ⅰ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L-1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为_____________(保留两位有效数字)。滴定达到终点的标志是_____________。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
(2)然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的_______。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(3)常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为_______,Fe3+完全沉淀时溶液的pH为________(已知 lg5 = 0.7 )