题目内容
【题目】导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
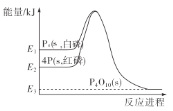
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是__(填序号)。
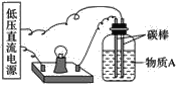
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是__(填字母)。
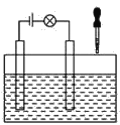
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(3)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。若在(2)题图中,电解质溶液为Ca(OH)2溶液,向溶液中逐渐通入CO2。则:下列四个图中,__(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
A.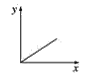 B.
B.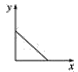 C.
C.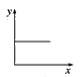 D.
D.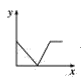
【答案】⑤⑥⑦⑧ D D
【解析】
(1)电解质溶液导电性与离子浓度成正比、与离子电荷成正比,若灯泡亮,说明广口瓶中电解质溶液中含有大量自由移动离子;
(2)溶液导电性强弱由离子浓度大小及所带电荷数多少等因素决定,实验时灯泡能出现由亮-暗-熄灭-亮,说明在滴加溶液过程中导致离子浓度减小,最终为0,再继续滴加溶液,离子浓度逐渐增大;
(3)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水,若在Ca(OH)2溶液中逐渐通入CO2,溶液中离子浓度先减小到几乎为零,后又逐渐增大,据此分解答。
(1)若灯泡亮,则广口瓶内的物质A含有大量自由移动的离子,氯化钠、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不导电,两者溶于水后,在水分子的作用下,离解成自由移动的阴、阳离子(实为水合离子),所以二者的水溶液能导电;蔗糖晶体和酒精均由分子构成,不能导电,其水溶液也不导电;稀盐酸、硫酸铜溶液中均含有大量自由移动的离子,可以导电;综上所述,⑤⑥⑦⑧可以导电;故答案为:⑤⑥⑦⑧;
(2)溶液能否导电,取决于溶液中是否有自由移动的离子存在;导电性强弱则由离子浓度大小及所带电荷数多少等因素决定,
A. 盐酸中逐滴加入食盐溶液,不发生反应,混合后仍为强电解质溶液,溶液存在大量自由移动的离子,可导电,不会熄灭,故A不符合;
B. 硫酸中逐滴加入氢氧化钠溶液生成硫酸钠,仍为强电解质溶液,溶液存在大量自由移动的离子,可导电,不会熄灭,故B不符合;
C. 石灰乳中滴加稀盐酸,石灰乳中Ca(OH)2溶解度小,加稀盐酸生成了可溶性的CaCl2,导电能力增强,灯泡变亮,故C不符合;
D. 发生反应H2SO4+Ba(OH)2===BaSO4↓+2H2O,溶液中离子浓度减小,恰好完全反应时,溶液中几乎没有离子,灯泡熄灭,继续滴加Ba(OH)2溶液,Ba(OH)2过量,溶液中Ba2+、OH-数目增多,灯泡逐渐变亮,故D符合;故答案为:D;
(3)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水,若在Ca(OH)2溶液中逐渐通入CO2,先发生反应CO2+Ca(OH)2=CaCO3↓+H2O,溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,当开始发生反应CaCO3+CO2+H2O=Ca(HCO3)2,随着反应的进行,离子浓度又逐渐增大,导电能力又逐渐增大,故D符合;故答案为:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在 3 个体积均为 2.0 L 的恒容密闭容器中,反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度 (T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.当温度为 T1时,该反应的化学平衡常数值为 0.25
B.若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) = 0.05mol·L-1·min-1
C.达到平衡时,容器 II 中H2O的转化率比容器 I 中的小
D.达到平衡时,容器 III 中的 CO 的转化率小于 50%