题目内容
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
【答案】C
【解析】
①C完全燃烧放出的热量较多,因ΔH<0,则前者小于后者,故①错误;
②固体变为气体要吸热,则后者放出的热量多,因ΔH<0,前者大于后者,故②正确;
③参加反应的物质的量越大,反应的热量越多,因ΔH<0,前者大于后者,故③正确;
④碳酸钙分解为吸热反应,ΔH>0,氧化钙和水反应为放热反应,ΔH<0,则前者大于后者,故④正确;
②③④正确,故选C。

【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
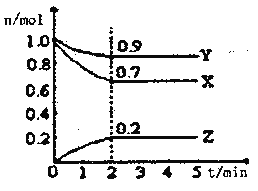
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量
C.减小压强 D.增加物质Z的物质的量.
E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将_________。
a.延长 b.缩短 c.不变 d.无法确定