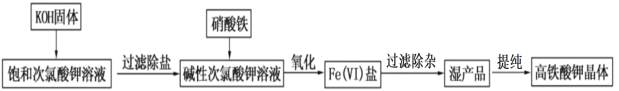
题目内容
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
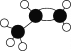
(1)基态砷原子中,价电子占用__个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为__。

(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是__(填元素符号),SO42-的空间构型为__,晶体中含有的化学键有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是__。
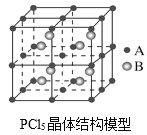
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为__,B为__。
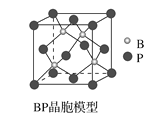
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为xcm,磷化硼的摩尔质量为bg·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式为__g·cm-3。
【答案】4 sp3杂化 N>O>S 正四面体 离子键、共价键和配位键 乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度 PCl4+ PCl6- ![]()
【解析】
(1)基态砷原子中,4p轨道的3个电子要分占不同的轨道并且自旋状态相同;由雌黄分子结构示意图可知,每个砷原子与3个硫原子形成3个σ键,由于其价电子数是5个,所以该分子中砷原子有1个孤电子对,根据价层电子对互斥理论,中心原子的价电子对数为4;
(2)一般非金属性越强的元素的第一电离能也越大;SO42-的价层电子对数为4,孤对电子数为0,空间构型为正四面体;[Cu(NH3)4]SO4·H2O晶体是一种配合物,其内界中心原子铜离子和配体氨分子之间形成配位键,氨分子内有极性键,外界硫酸根与内界之间形成离子键;加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性;
(3)A微粒与CCl4具有相同的空间构型和相似的化学键特征,所以A与四氯化碳是等电子体,则A为PCl4+,由质量守恒和电荷守恒可知B为PCl6—;
(4)由分摊法计算可得。
(1)基态砷原子中,价电子排布式为4s24p3,根据洪特规则,4p轨道的3个电子要分占不同的轨道并且自旋状态相同,所以其价电子共占用4个原子轨道;由雌黄分子结构示意图可知,每个砷原子与3个硫原子形成3个σ键,由于其价电子数是5个,所以该分子中砷原子有1个孤电子对,根据价层电子对互斥理论,中心原子的价电子对数为4,所以中心原子的杂化方式为sp3杂化,故答案为:4;sp3杂化;
(2)一般非金属性越强的元素的第一电离能也越大,但是每个周期的ⅡA(s轨道全满)和ⅤA族(p轨道半充满)元素因其原子结构的特殊性,其第一电离能高于相邻元素,所以N、O、S第一电离能由大到小的顺序是N>O>S;SO42-的价层电子对数为4,孤对电子数为0,空间构型为正四面体;[Cu(NH3)4]SO4·H2O晶体是一种配合物,其内界中心原子铜离子和配体氨分子之间形成配位键,氨分子内有极性键,外界硫酸根与内界之间形成离子键;加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度,故答案为:N>O>S;正四面;离子键、共价键和配位键;乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(3)A微粒与CCl4具有相同的空间构型和相似的化学键特征,所以A与四氯化碳是等电子体,则A为PCl4+,由质量守恒和电荷守恒可知B为PCl6—,故答案为:PCl4+;PCl6-;
(4)该晶胞中含有4个硼原子和4个磷原子。如果把晶胞分成8个相同的小立方,则硼原子恰好可以位于其中4个小立方的体心,设晶胞的边长为2a,晶体中最近的硼原子和磷原子核间距为x cm,则x=![]() acm,所以a=
acm,所以a=![]() x,1 mol该晶胞的体积为NA(2a)3=NA(
x,1 mol该晶胞的体积为NA(2a)3=NA(![]() cm)3,磷化硼的摩尔质量为b g·mol-1,则1 mol该晶胞中含BP 4 mol,其质量为4b g,所以磷化硼晶体密度的表达式为
cm)3,磷化硼的摩尔质量为b g·mol-1,则1 mol该晶胞中含BP 4 mol,其质量为4b g,所以磷化硼晶体密度的表达式为![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。

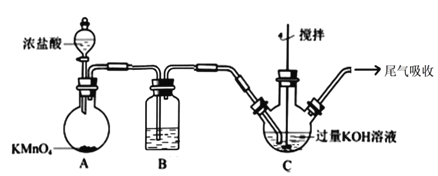
【题目】实验室中有一未知浓度的稀盐酸,某同学为测定该盐酸的浓度,在实验室中进行了如下实验。
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→_________→__________→装瓶→贴标签。
②称量________g氢氧化钠固体粉末,所需仪器有:托盘天平(带砝码和镊子)、___________、小烧瓶。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) | |
1 | 0.10 | 29.80 | 20.00 | |
2 | 0.10 | 30.00 | 20.00 | |
3 | 0.10 | 30.20 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
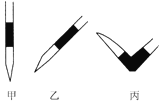
③排去碱式滴定管中气泡的方法应采用如图所示操作中的____________(选择甲、乙、丙填空),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失