题目内容
【题目】高铁酸钾在饮用水源和废水处理过程中,不仅能去除污染物和致癌化学污染物,而且不产生任何诱变致癌的产物,具有高度的安全性;其可溶于水,微溶于浓 KOH 溶液,且在强碱性溶液中比 较稳定。实验室用次氯酸盐氧化法制备高铁酸钾(K2FeO4)的流程如图所示:
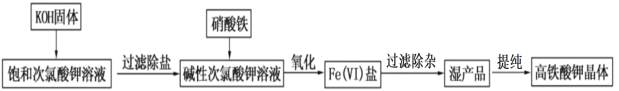
流程图中的饱和次氯酸钾溶液的制备装置如图所示:
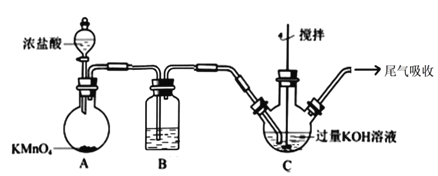
(1)A 为氯气发生装置。A 中反应的离子方程式是___________;装置 B 内的试剂及作用是____________;
(2)装置 C 反应温度控制在 0~5℃进行,在不改变 KOH 溶液浓度前提下,实验中可采取措施是________。
(3)流程图中在加入 KOH 固体的时候会产生大量的白色沉淀_____(填化学式)。
(4)在搅拌下,将 Fe(NO3)3饱和溶液缓慢滴加到 KClO 饱和溶液中即可制取 K2FeO4,写出该反应的离子方程式__________;反应过程中温度控制在 10~15℃,温度过低或过高对反应的影响是_____________。
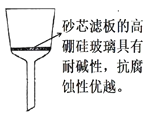
(5)过滤除杂时不用普通漏斗和滤纸而采用砂芯漏斗(如图)的原因是_____________。
(6)在提纯高铁酸钾时采用重结晶、洗涤、干燥的方法,洗涤剂可以选用_____。
A.H2O B.浓 KOH 溶液 C.Fe(NO3)3溶液 D.异丙醇
(7)若提纯得到 a gK2FeO4(M=198g/mol),上述流程中有 5%的 Fe 损失,则需要提供 Fe(NO3)3(M=242g/mol)的质量为_____g(用含 a 的计算式表示)。
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 饱和食盐水、吸收杂质HCl气体 将C装置置于冰水浴中冷却 KCl 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 温度过低或过高对反应的影响是温度太低,反应速率慢影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降; 普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好 BD ![]() g
g
【解析】
A装置制备氯气,B装置除去氯气中混有的HCl气体,C装置制备K2FeO4,尾气吸收装置吸收未反应的氯气,防止污染空气。
(1)A 为氯气发生装置,高锰酸钾与浓盐酸生成氯化锰和氯气。A 中反应的离子方程式是2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;生成的氯气中含有氯化氢,装置 B 内的试剂是饱和食盐水,作用是吸收HCl气体;故答案为:2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;饱和食盐水、吸收杂质HCl气体;
(2)C装置制备K2FeO4,反应温度控制在 0~5℃进行,在不改变 KOH 溶液浓度前提下,实验中可采取措施是将C装置置于冰水浴中冷却。故答案为:将C装置置于冰水浴中冷却;
(3)发生的反应方程式为2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,KCl溶解度小,饱和后易析出,流程图中在加入 KOH 固体的时候会产生大量的白色沉淀KCl。故答案为:KCl;
(4)在搅拌下,将 Fe(NO3)3饱和溶液缓慢滴加到 KClO 饱和溶液中即可制取 K2FeO4,在KOH溶液中,Fe(NO3)3与KClO应生成K2FeO4、KCl和KNO3,反应的方程式为:2 Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,该反应的离子方程式3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;反应过程中温度控制在 10~15℃,温度过低或过高对反应的影响是温度太低,反应速率慢,影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降。故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;温度过低或过高对反应的影响是温度太低,反应速率慢,影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降;
(5)过滤除杂时不用普通漏斗和滤纸而采用砂芯漏斗的原因是普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好。故答案为:普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好;
(6)K2FeO4可溶于水、微溶于浓KOH溶液,在异丙醇中溶解度也比较小,在提纯高铁酸钾时采用重结晶、洗涤、干燥的方法,洗涤剂可以选用B.浓 KOH 溶液D.异丙醇;故答案为:BD。
(7)由铁原子守恒:Fe(NO3)3~K2FeO4
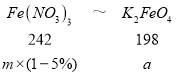
m=![]() g,故答案为:
g,故答案为:![]() g。
g。

 名校课堂系列答案
名校课堂系列答案