题目内容
8.已知:t℃时,2H(g)+Y(g)?2I(g)△H=-196.6kJ•mol-1,t℃时,在一压强恒定的密闭容器中,加入4mol H和2mol Y反应,达到平衡后,Y剩余0.2mol.若在上面的平衡体系中,再加入1mol气态的I物质,t℃时达到新的平衡,此时H物质的物质的量n(H)为( )| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
分析 根据热化学反应方程式及加入4molH和2molY反应,达到平衡后,Y剩余0.2mol,平衡体系中,再加入1molI气体,则利用极限转化,相等于加入反应物,然后利用化学平衡等效,H的含量相同来进行计算即可解答.
解答 解:Y剩余0.2mol,则平衡时,H为0.4mol,I为3.6mol,
2H(g)+Y(g)?2I(g);
开始4 2 0
转化3.6 1.8 3.6
平衡0.4 0.2 3.6
H的含量为$\frac{0.4mol}{0.4mol+0.2mol+3.6mol}$×100%=9.5%,
在上面的平衡体系中,再加入1mol I气体,平衡逆向移动,
温度、压强恒定的密闭容器,相等于又加入1molH和0.5molY反应,
起始的量成正比,化学平衡等效,H 的含量相同,
设转化的H的物质的量为y,则$\frac{1-y}{1-y+0.5-0.5y+y}$×100%=9.5%,
解得y=0.9mol,
则达到化学平衡时H的物质的量为0.4mol+(1-0.9)mol=0.5mol,
故选C.
点评 本题较难,考查学生利用热化学反应方程式和热量的关系及等效平衡中的计算,明确H的含量不变及极限思维方法来解题是解答本题的关键.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
16.(1)我国酸雨属SO2污染型.某校兴趣小组取雨水样品进行实验.每隔一段时间测定雨水的pH,得到的结果如下表
该雨水样品的pH变化的原因用化学方程式表示2H2SO3+O2=2H2SO4或2SO2+2H2O+O2=2H2SO4.
(2)下列一组能减少酸雨产生的有效措施是B(填字母).
①少用煤作燃料 ②加大石油、煤炭的开采速度,增加化石燃料的供应量
③燃料脱硫 ④在已酸化的土壤中加入石灰 ⑤开发新能源
A.①②⑤B.①③⑤C.②③④D.③④⑤
(3)氯系消毒剂是目前使用最广泛的一类消毒剂.家庭使用漂白粉进行消毒时,可直接将漂白粉置于空气中,请写出反应的化学方程式Ca(ClO)2+CO2+H2O═CaCO3+2HClO.
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(2)下列一组能减少酸雨产生的有效措施是B(填字母).
①少用煤作燃料 ②加大石油、煤炭的开采速度,增加化石燃料的供应量
③燃料脱硫 ④在已酸化的土壤中加入石灰 ⑤开发新能源
A.①②⑤B.①③⑤C.②③④D.③④⑤
(3)氯系消毒剂是目前使用最广泛的一类消毒剂.家庭使用漂白粉进行消毒时,可直接将漂白粉置于空气中,请写出反应的化学方程式Ca(ClO)2+CO2+H2O═CaCO3+2HClO.
3.化学与能源开发、环境保护等密切相关.下列说法正确的是( )
| A. | 开发核能、太阳能、氢能等新能源,使用无磷洗涤剂都可直接降低碳排放 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 针对节能减排需要大力建设火力发电站 |
13.下列物质互为同分异构体的是( )
| A. | 1-丁烯和1,3-丁二烯 | B. | 己烷和环己烷 | ||
| C. | 尿素和氰酸铵(NH4CNO) | D. | 1,4-二甲苯和1,3,5-三甲苯 |
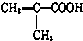 )$\stackrel{一定条件}{→}$PMAA
)$\stackrel{一定条件}{→}$PMAA .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O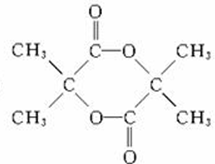 .
.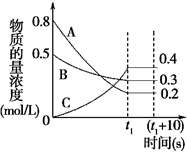 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: