题目内容
17.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量大于100小于150,若分子中氧的质量分数为40%,则含C原子个数为( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
分析 根据有机物相对分子质量及氧的质量分数为确定分子中氧原子数目,再计算碳原子、氢原子的相对原子质量之和,根据碳原子相对原子质量确定碳原子最大值,碳原子数目最大时分子中碳元素的质量分数的最大.
解答 解:相对分子质量小于150,由氧的质量分数为可知,则分子中氧原子数目小于为$\frac{150×40%}{16}$=3.75,当有机物分子中含氧原子的数目为3时,有机物的相对分子质量最大,据此得出该有机物的相对分子质量为:$\frac{3×16}{40%}$=120,设分子中含有x个C,y个H,则有12x+y=120-3×16=72,当y=10时,x=5,若x=6,则y=0,不符合题意,所以分子中碳原子的个数最多为5,故选:B.
点评 本题主要考查有机物分子式的确定,难度中等,确定有机物中氧原子的数目及碳原子数目是具体关键.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 某无色溶液中:Al3+、Cu2+、SO42-、Cl- | |
| B. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Fe2+、K+、Cl-、NO3- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Na+、Mg2+、NO3-、Cl- | |
| D. | 含有大量HCO3-的溶液中:NH4+、Al3+、Ca2+、Cl- |
8.已知:t℃时,2H(g)+Y(g)?2I(g)△H=-196.6kJ•mol-1,t℃时,在一压强恒定的密闭容器中,加入4mol H和2mol Y反应,达到平衡后,Y剩余0.2mol.若在上面的平衡体系中,再加入1mol气态的I物质,t℃时达到新的平衡,此时H物质的物质的量n(H)为( )
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式 | B. | Cl-的结构示意图: | ||
| C. | 乙烯的结构简式C2H4 | D. | Z质量数为37的氯原子${\;}_{37}^{17}$Cl |
9.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
6.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
2.核电荷数为1~18的元素中,下列说法正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 最外层电子数为7的原子,最高正价为+7 |
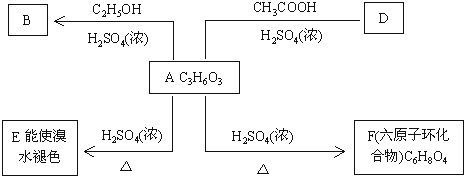

 .
.