题目内容
20.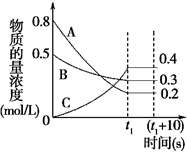 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:(1)该反应的化学方程式为3A+B?2C.
(2)0~t1 s内A气体的反应速率为$\frac{0.6}{{t}_{1}}$mol•L-1•s-1.
(3)反应后与反应前的压强之比为9:13.
(4)(t1+10)s时,A气体的体积分数为$\frac{2}{9}$,此时v(A)正>v(B)逆(填“>”、“<”或“=”).
(5)关于该反应的说法正确的是bc.
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率.
分析 (1)根据图知,随着反应的进行,A、B的浓度降低、C的浓度升高,则A和B是反应物、C是生成物,△c(A)=(0.8-0.2)mol/L=0.6mol/L,△c(B)=(0.5-0.3)mol/L=0.2mol/L,△c(C)=(0.4-0)mol/L=0.4mol/L,同一可逆反应中,同一时间段内各物质浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2;
(2)0~t1 s内A气体的反应速率=$\frac{△c}{△t}$;
(3)恒温、恒容条件下,物质的量之比等于其压强之比,还等于其物质的量浓度之和之比,反应前气体浓度之和为(0.8+0.5)mol/L=1.3mol/L,反应后混合气体浓度之和=(0.4+0.3+0.2)mol/L=0.9mol/L;
(4)体积分数之比等于物质的量浓度之比;同一物质的平衡状态正逆反应速率相等,但不同物质的反应速率之比等于其计量数之比;
(5)t1时刻反应达到平衡状态,正逆反应速率相等.
解答 解:(1)根据图知,随着反应的进行,A、B的浓度降低、C的浓度升高,则A和B是反应物、C是生成物,△c(A)=(0.8-0.2)mol/L=0.6mol/L,△c(B)=(0.5-0.3)mol/L=0.2mol/L,△c(C)=(0.4-0)mol/L=0.4mol/L,同一可逆反应中,同一时间段内各物质浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以该反应方程式为3A+B?2C,故答案为:3A+B?2C;
(2)0~t1 s内A气体的反应速率=$\frac{△c}{△t}$=$\frac{0.6}{{t}_{1}}$mol•L-1•s-1,故答案为:$\frac{0.6}{{t}_{1}}$mol•L-1•s-1;
(3)恒温、恒容条件下,物质的量之比等于其压强之比,还等于其物质的量浓度之和之比,反应前气体浓度之和为(0.8+0.5)mol/L=1.3mol/L,反应后混合气体浓度之和=(0.4+0.3+0.2)mol/L=0.9mol/L,所以反应后与反应前的压强之比=0.9mol/L:1.3mol/L=9:13,故答案为:9:13;
(4)体积分数之比等于物质的量浓度之比=0.2mol/L:(0.4+0.3:0.2)mol/L=$\frac{2}{9}$;同一物质的平衡状态正逆反应速率相等,但不同物质的反应速率之比等于其计量数之比,所以v(A)正>v(B)逆,
故答案为:$\frac{2}{9}$;>;
(5)a.到达t1时刻正逆反应速率相等,但该反应为动态平衡状态,不停止,故错误;
b.在t1时刻之前,该反应向正反应方向移动,所以正反应速率大于逆反应速率,则B气体的消耗速率大于它的生成速率,故正确;
c.在t1时刻达到平衡状态,则C气体的正反应速率等于逆反应速率,故正确;
故选bc.
点评 本题考查图象分析,侧重考查学生分析计算能力,涉及反应速率、压强的计算及平衡状态判断等知识点,明确图中纵横坐标含义是解本题关键,知道平衡状态判断方法,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 胶体、溶液、浊液的分类依据是分散质微粒直径大小 | |
| B. | “卤水点豆腐”、“黄河入海口处的沙洲”都与胶体的聚沉有关 | |
| C. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 | |
| D. | 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 |
| A. | Li、C、O原子最外层电子数依次增加 | B. | P、S、Cl元素最高正化合价依次升高 | ||
| C. | N、O、F原子半径依次增大 | D. | Li、Na、K的金属性依次增强 |
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
| A. | 赤铁矿:Fe2O3 | B. | 硫铁矿:FeS | ||
| C. | 玛瑙:SiO2 | D. | 芒硝:Na2SO4•10H2O |
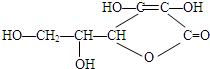 有机化合物的化学性质本质上就是分子结构中所含官能团的性质:
有机化合物的化学性质本质上就是分子结构中所含官能团的性质: ;
;

 .
.