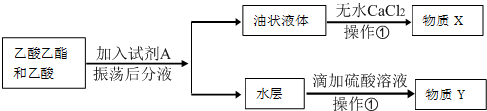
题目内容
18.汽车发生强烈碰撞时,安全气囊内的NaH发生化学反应生成金属钠与氢气,所产生的气体快速充满气囊,可以达到保护车内人员的目的.(1)请写出上述反应方程式:2NaH═2Na+H2↑它的基本反应类型是分解反应.
(2)若安全气囊内含有96g NaH,其物质的量为4mol.
(3)若96g NaH完全分解,在标况下,气囊膨胀的体积约为44.8L.
分析 (1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为:2NaH═2Na+H2↑,一种物质转化为两种物质;
(2)根据n=$\frac{m}{M}$,计算96gNaH的物质的量;
(3)根据方程式计算生成氮气的物质的量,再根据V=nVm计算氮气的体积.
解答 解:(1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为2NaH═2Na+H2↑,一种物质转化为两种物质,所以是分解反应,
故答案为:2NaH═2Na+H2↑;分解反应;
(2)96gNaH的物质的量=$\frac{96}{24}$=4mol,故答案为:4mol;
(3)96g NaH完全分解,设生成氢气的物质的量为n,则:
2NaH═2Na+H2↑,
2 1
4mol n
n=2mol
故标况下生成氮气的体积=2mol×22.4L/mol=44.8L,
故答案为:44.8L.
点评 本题考查物质的量计算、化学方程式计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
8.已知:t℃时,2H(g)+Y(g)?2I(g)△H=-196.6kJ•mol-1,t℃时,在一压强恒定的密闭容器中,加入4mol H和2mol Y反应,达到平衡后,Y剩余0.2mol.若在上面的平衡体系中,再加入1mol气态的I物质,t℃时达到新的平衡,此时H物质的物质的量n(H)为( )
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
9.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
6.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
3. 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+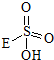 →
→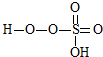 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.
(4)F位于d区,价电子排布式为3d54s1.
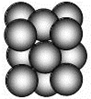
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
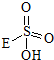 →
→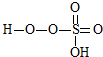 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.(4)F位于d区,价电子排布式为3d54s1.
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
5.下列物质的主要成分不正确的是( )
| A. | 赤铁矿:Fe2O3 | B. | 硫铁矿:FeS | ||
| C. | 玛瑙:SiO2 | D. | 芒硝:Na2SO4•10H2O |
2.核电荷数为1~18的元素中,下列说法正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 最外层电子数为7的原子,最高正价为+7 |
3.下列有关O2的摩尔质量表示正确的是( )
| A. | 32 | B. | 32g | C. | 32mol | D. | 32g/mol |
 乙
乙 丙
丙

 )
)