题目内容
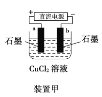
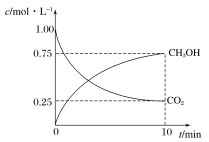
【题目】已知X(g)和Y(g)可以相互转化:2X(g)![]() Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
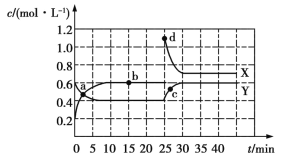
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30 min内用X表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
【答案】D
【解析】
正反应是气体分子数减小的反应,所以当压强不再发生变化时反应达到平衡;各物质的浓度不再发生变化时表示反应处于平衡状态;X表示化学反应的平均速率为X浓度的变化量除以反应时间;曲线发生变化的瞬间可以判断反应条件的改变。
正反应是气体分子数减小的反应,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A正确;根据图象可知,只有b点表示的反应体系中,各物质的浓度不再发生变化,所以只有b点表示反应处于平衡状态,B正确;25~30 min内X的浓度变化量是0.4 mol·L-1,所以用X表示化学反应的平均速率是![]() =0.08 mol·L-1·min-1,C正确;由图可知,反应进行至25 min时, 曲线发生变化的原因是X物质的浓度增大,D错误。
=0.08 mol·L-1·min-1,C正确;由图可知,反应进行至25 min时, 曲线发生变化的原因是X物质的浓度增大,D错误。
故选D。

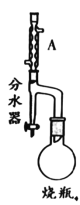
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
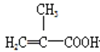 +CH3OH
+CH3OH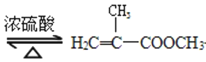 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失