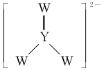
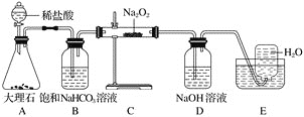
题目内容
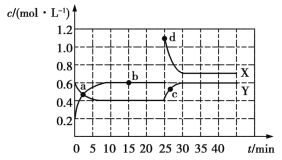
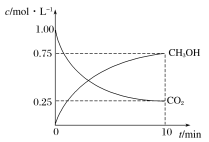
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
(1)该反应的平衡常数K表达式为________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______,H2的转化率为_______。
(3)下列叙述中,能说明反应已达到化学平衡状态的是________(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1
B.v正(CO2)∶v逆(H2)=1∶3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______。
【答案】K= 0.075mol·L-1·min-1 50% BD CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4kJ·mol-1
0.075mol·L-1·min-1 50% BD CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4kJ·mol-1
【解析】
(1)平衡常数等于生成物浓度幂之积与反应物浓度幂之积之比,即K= ,故答案为:
,故答案为: ;
;
(2)0~10min时间内,CH3OH的物质的量浓度变化量=0.75mol/L,则v(CH3OH)=![]() =0.075mol·L-1·min-1,所以,v(H2O)=v(CH3OH)=0.075mol·L-1·min-1。生成甲醇的物质的量=0.75mol/L×2L=1.5mol,则转化了的氢气的物质的量=3×1.5mol=4.5mol,那么氢气的转化率=
=0.075mol·L-1·min-1,所以,v(H2O)=v(CH3OH)=0.075mol·L-1·min-1。生成甲醇的物质的量=0.75mol/L×2L=1.5mol,则转化了的氢气的物质的量=3×1.5mol=4.5mol,那么氢气的转化率=![]() =50%,故答案为:0.075mol·L-1·min-1;50%;
=50%,故答案为:0.075mol·L-1·min-1;50%;
(3)达到平衡时,v正=v逆≠0,体系中各成分的量保持不变。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1不代表CO2、H2、CH3OH、H2O(g)的量不变,不能判断是否平衡,A错误;
B.由方程式计量数可知v逆(H2)=3v逆(CO2),又因为v正(CO2)∶v逆(H2)=1∶3,即v逆(H2)=3v正(CO2),所以,3v逆(CO2)= 3v正(CO2),v逆(CO2)= v正(CO2),说明反应已平衡,B正确;
C.平衡常数K只和温度有关,温度不变,K不变,故平衡常数K保持不变,不能说明反应是否平衡,C错误;
D.该反应是一个气体总质量m不变,气体总物质的量n减小的反应,由n=![]() 可知,当混合气体的平均相对分子质量保持不变,即M不变,那么n也不变,说明已达到平衡,D正确;
可知,当混合气体的平均相对分子质量保持不变,即M不变,那么n也不变,说明已达到平衡,D正确;
综上所述,BD能说明反应已达平衡,故答案为:BD。
(4)![]() 得:CH3OH(l)+O2(g)=2H2O(l)+CO(g),ΔH=
得:CH3OH(l)+O2(g)=2H2O(l)+CO(g),ΔH=![]() =-443.4kJ·mol-1,故答案为:CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4kJ·mol-1。
=-443.4kJ·mol-1,故答案为:CH3OH(l)+O2(g)=2H2O(l)+CO(g) ΔH=-443.4kJ·mol-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室以蛇纹石酸浸出液![]() 主要含
主要含![]() ,还有一定量的
,还有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 等
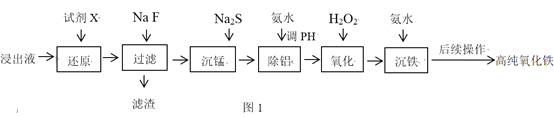
等![]() 为原料制备高纯氧化铁,流程如图1:
为原料制备高纯氧化铁,流程如图1:
已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
氢氧化物 |
|
|
|
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
已知:在该温度下,Ksp(CaF2)=2.0×10-10 Ksp(MnF2)=5.0×10-3 Ksp(MgF2)=7.4×10-11
(1)“还原”时,应选择______![]() 填字母
填字母![]() .
.
A.Zn粉![]() 溶液
溶液![]() 粉
粉
(2)“滤渣”的主要成分除含有少量![]() 外,还含有______
外,还含有______![]() 填化学式
填化学式![]() .
.
(3)“沉锰”时,已知:![]() 为确保沉锰完全
为确保沉锰完全![]() 即溶液中
即溶液中![]() ,应保持溶液中
,应保持溶液中![]() ______
______![]() .
.
(4)“除铝”时,控制溶液pH的范围为_____________
(5)“氧化”时,常用酸性![]() 溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为__________
溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为__________
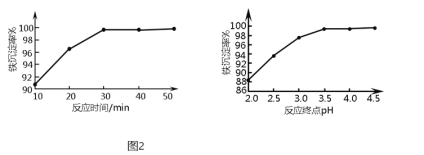
(6)“沉铁”时,反应温度为![]() 条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是______.
条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是______.