题目内容
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是
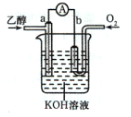
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+2e-===Cl2↑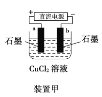
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+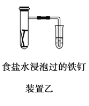
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-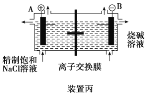
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成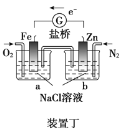
【答案】C
【解析】
A.阳极上Cl-发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故A错误;
B.铁单质放电过程中生成亚铁离子,Fe上的反应为:Fe-2e-=Fe2+,故B错误;
C.B电极外接电源负极,发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,故C正确;
D.外电路电子移向Fe电极,a极区O2发生还原反应,溶液中无Fe2+,因此向烧杯a中加入少量K3[Fe(CN)6]溶液,无蓝色沉淀生成,故D错误;
故答案为:C。

【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
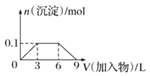
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
C | 常温下,用pH计分别测定0.1moI/LNaA溶液的0.1moI/LNaB溶液的pH | pH:NaA>NaB | 能证明酸性:HA>HB |
D | 向盛有1mL0.lmol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【题目】实验室以蛇纹石酸浸出液![]() 主要含
主要含![]() ,还有一定量的
,还有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 为原料制备高纯氧化铁,流程如图1:
为原料制备高纯氧化铁,流程如图1:
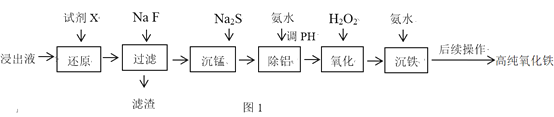
已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
氢氧化物 |
|
|
|
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
已知:在该温度下,Ksp(CaF2)=2.0×10-10 Ksp(MnF2)=5.0×10-3 Ksp(MgF2)=7.4×10-11
(1)“还原”时,应选择______![]() 填字母
填字母![]() .
.
A.Zn粉![]() 溶液
溶液![]() 粉
粉
(2)“滤渣”的主要成分除含有少量![]() 外,还含有______
外,还含有______![]() 填化学式
填化学式![]() .
.
(3)“沉锰”时,已知:![]() 为确保沉锰完全
为确保沉锰完全![]() 即溶液中
即溶液中![]() ,应保持溶液中
,应保持溶液中![]() ______
______![]() .
.
(4)“除铝”时,控制溶液pH的范围为_____________
(5)“氧化”时,常用酸性![]() 溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为__________
溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为__________
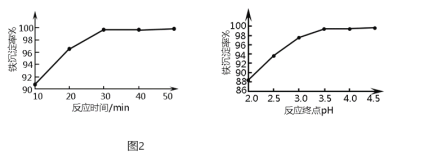
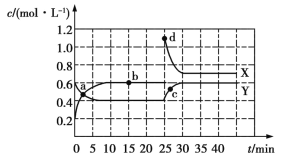
(6)“沉铁”时,反应温度为![]() 条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是______.
条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是______.