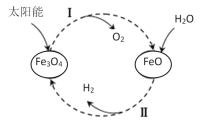
题目内容
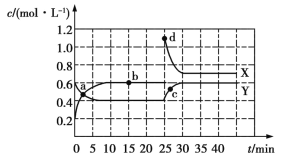
【题目】密闭容器中进行的可逆反应aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
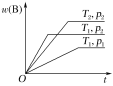
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
【答案】B
【解析】
升高温度、增大压强,反应速率均增大,到达平衡的时间缩短。
温度都为T1,压强为p2先达到平衡,p2>p1,p1到p2,平衡时B的质量分数增大,即增大压强,平衡逆向移动,故a+b<c;
压强都为p2,T1条件下先达到平衡,T1>T2,T1到T2,平衡时B的质量分数增大,即降低温度,平衡逆向移动,故逆反应是放热反应,正反应是吸热反应;
综上所述,T1>T2,p1<p2,a+b<c,正反应为吸热反应,B正确。
答案选B。

【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
C | 常温下,用pH计分别测定0.1moI/LNaA溶液的0.1moI/LNaB溶液的pH | pH:NaA>NaB | 能证明酸性:HA>HB |
D | 向盛有1mL0.lmol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
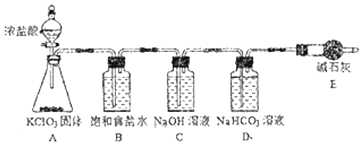
(1)该小组按如图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
①装置A中反应的化学方程式为____。
②B瓶溶液中H+的主要来源是____。
③C瓶溶液的溶质是___(填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因____。
(2)测定C瓶溶液中NaClO含量(单位:gL-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000molL-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
①NaClO的电子式为____。
②步骤Ⅰ总反应的离子方程式为____。
③C瓶溶液中NaClO的含量为____gL-1。(保留1位小数,NaClO式量为74.5)