题目内容
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
| A.c=1000b/11.2V | B.p=m+Vc/125 | C.n=m+17Vc | D.5/3m<p<17/9m |
C
解析试题分析: A、根据得失电子守恒,金属失去的电子总数等于H+得到的电子总数,且等于金属离子结合的OH-总数,由 得c=1000b/11.2V,正确;B、根据质量守恒,固体pg= mg+m(O2-)= m+Vc/125,正确;C、ng= mg+m(OH-)= m+17Vc/1000,错误。D、利用极端假设法,当全是金属镁时p="m/24" ×40g/mol=5/3m,当全是金属铝时p=(m/27)/2 ×102g/mol=17/9m,正确。
得c=1000b/11.2V,正确;B、根据质量守恒,固体pg= mg+m(O2-)= m+Vc/125,正确;C、ng= mg+m(OH-)= m+17Vc/1000,错误。D、利用极端假设法,当全是金属镁时p="m/24" ×40g/mol=5/3m,当全是金属铝时p=(m/27)/2 ×102g/mol=17/9m,正确。
考点:考察元素及其化合物性质、化学反应的计算。

用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1mol Na2O2固体中含有O22-2 NA |
| B.常温常压下,3.2 g CH4中含有电子2 NA |
| C.标准状况下,11.2 L CH3CH2OH中含有分子0.5NA |
| D.100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子0.1 NA |
下列化学用语正确的是
A.铝离子的结构示意图: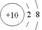 | B.CaH2的电子式:[H:]?Ca2+[:H]- |
C.CO2的比例模型:  | D.核内有8个中子的碳原子: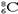 |
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.(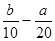 )mol/L )mol/L | B.(2b—a)mol/L | C.(l0b - 5a) mol/L | D.(5b一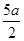 )mol/L )mol/L |
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气 L L |
B.反应后溶液中的Cl―数目为: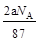 |
C.NA可表示为: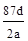 |
D.反应后溶液中的H+数目为: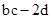 |
1molSO2和1molSO3具有相同的:①分子数;②原子数;③S原子数;④O原子数
| A.①② | B.①③ | C.①④ | D.②④ |
在某溶液中仅存在NH4+、Fe3+、SO42—三种离子,已知NH4+和SO42—个数比为3︰2,则NH4+、Fe3+、SO42—三种离子的个数比为
| A.6︰1︰9 | B.3︰1︰2 | C.1︰1︰1 | D.9︰1︰6 |
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w=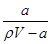 ×100% ×100% |
B.溶质的物质的量浓度c= mol·L-1 mol·L-1 |
C.溶液中c(OH-)=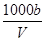 mol·L-1+c(H+) mol·L-1+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w |