题目内容
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气 L L |
B.反应后溶液中的Cl―数目为: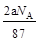 |
C.NA可表示为: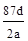 |
D.反应后溶液中的H+数目为: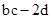 |
C
解析试题分析: 根据反应4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,知A、盐酸没有完全反应,错误;B、盐酸过量,反应后溶液中的Cl―数目为bcNA -2d,错误;C、反应中转移电子d=
MnCl2+Cl2↑+2H2O,知A、盐酸没有完全反应,错误;B、盐酸过量,反应后溶液中的Cl―数目为bcNA -2d,错误;C、反应中转移电子d= ,NA=87d/2a,正确。D、反应后溶液中的H+数目为:(bc-2d)NA,错误。
,NA=87d/2a,正确。D、反应后溶液中的H+数目为:(bc-2d)NA,错误。
考点:考查元素及其化合物,化学计算知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
NA表示阿伏加德罗常数,下列说法中正确的是
| A.H2SO4的摩尔质量是98 |
| B.1.7g NH3含有的电子数为NA |
| C.摩尔、质量、时间、长度等是7个基本物理量之一 |
| D.22.4L氧气含有的分子数为NA |
对下列化学用语的理解和描述均正确的是
A.原子结构示意图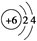 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
B.比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C.结构示意图为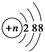 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D.电子式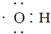 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标准状况下,11.2 L SO3所含的分子数目为0.5NA |
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
| A.c=1000b/11.2V | B.p=m+Vc/125 | C.n=m+17Vc | D.5/3m<p<17/9m |
在无土栽培液中,每升溶液需用0.98mol NH4Cl溶液、0.16 mol KCl溶液、0.24molK2SO4溶质作为培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量是
| A.0.4mol、0.5mol、0.12mol |
| B.0.66mol、0.5mol、0.24mol |
| C.0.64mol、0.5mol、0.24mol |
| D.0.64mol、0.02mol、0.24mol |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B.1.0L 0.1mol?L—1Na2CO3溶液中含有的CO32—离子数目为0.1NA |
| C.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NA |
| D.在标准状况下,2.24L的CH3CH2OH含有NA个分子 |
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 |
| C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023 |
| D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |