题目内容
(8分)(1)2 mol O3和3 mol O2的质量之比________,体积之比________.
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________ X的相对原子质量是________.
(1)1∶1 2∶3
(2)62 g·mol-1 16
解析试题分析:(1)O3和O2都是氧元素单质,质量比等于氧原子个数比,1∶1;根据阿伏伽德罗定律,气体体积比等于气体物质的量之比,2∶3。
(2) 12.4 g Na2X中含有0.4 mol钠离子,则Na2X为0.2mol,M(Na2X)=" 12.4" g/0.2mol="62" g·mol-1;X的相对原子质量=62-46=16。
考点:本题考察阿伏伽德罗定律及有关物质的量的计算。

 期末集结号系列答案
期末集结号系列答案向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
| A.c=1000b/11.2V | B.p=m+Vc/125 | C.n=m+17Vc | D.5/3m<p<17/9m |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,224mL水含有的电子数为0.1NA |
| B.1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO32- |
| C.足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA |
| D.标准状况下,11.2LCO2和SO2混合气体中含NA个氧原子 |
单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu2O、Cu。现将2.00g C与16.0g CuO的混合物,隔绝空气加热一段时间后,将生成的气体通过足量的澄淸石灰水,共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物中Cu的质量为12.8 g |
| C.反应后的固体混合物总质貴为14.4 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 |
| C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023 |
| D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
用NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4 L H2O中含有的分子数为NA |
| B.28 g N2中含有的分子数为NA |
| C.1 mol Mg与足量稀盐酸反应转移的电子数为NA |
| D.1 L 1 mol·L-1 Na2 CO3溶液中含有的钠离子数为NA |
在100 mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如下图所示,有关说法错误的是( )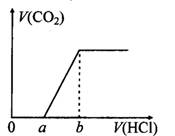
| A.若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+= HCO3- |
| B.若a:b>l:2,且b="20" mL,则原NaOH溶液的浓度为0.02 mol/L |
| C.若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D.a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
| A.120N/a | B.120a/11N | C.11a/120N | D.120N/11a |
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |