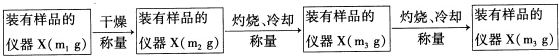
题目内容
19.五种短周期元素A、B、C、D、E的原子序数依次增大.A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成CE型的化合物.回答下列问题:
(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl.(填元素符号)
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是PH3(用化学式表示).
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为NH4Cl,其中存在的化学键类型为离子键和共价键.
(4)D最高价氧化物的水化物的化学式为H3PO4.
(5)单质D在充足的单质E中燃烧,反应的化学方程式为2P+5Cl2点燃_2PCl5;
(6)单质E与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
分析 五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和B形成的化合物在水中呈碱性,则化合物为氨气,则A为H,B为N;A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,则C为Na、D为P;A和B﹑D﹑E均能形成共价型化合物,则A为H元素;C和E形成CE型的化合物,则E的化合价为-1,最外层含有7个电子,原子序数大于Na,则E为Cl元素,据此进行解答.
解答 解:五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和B形成的化合物在水中呈碱性,则化合物为氨气,则A为H,B为N;A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,则C为Na、D为P;A和B﹑D﹑E均能形成共价型化合物,则A为H元素;C和E形成CE型的化合物,则E的化合价为-1,最外层含有7个电子,原子序数大于Na,则E为Cl元素,
(1)电子层越多、原子半径越大,电子层相同时,核电荷数越小,原子半径越大,则上述元素中,Na原子半价最大;同一周期中,原子序数越大,非金属性越强,则Cl的非金属性最强,
故答案为:Na;Cl;
(2)非金属性Cl>P,N>P,则热稳定性最差的是为PH3,
故答案为:PH3;
(3)HCl与氨气反应生成氯化铵,化学式为NH4Cl,氯化铵属于离子化合物,其化学式中存在离子键、共价键,
故答案为:NH4Cl;离子键和共价键;
(4)P元素的最高价氧化物的水化物的化学式为H3PO4,
故答案为:H3PO4;
(5)P在充足的氯气中燃烧生成五氯化磷,反应的化学方程式为:2P+5Cl2点燃_2PCl5,
故答案为:2P+5Cl2点燃_2PCl5;
(6)E的单质为氯气,氯气与水反应生成盐酸与次氯酸,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,题目难度中等,把握元素的位置、性质推断元素为解答的关键,侧重分析、推断及应用能力的综合考查.

| A. | 升高温度 | B. | 不断补充氮气 | ||
| C. | 增大压强 | D. | 及时将NH3从密闭容器中转移走 |
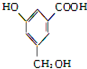 分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )| A. | 1:1:1 | B. | 1:3:2 | C. | 2:3:1 | D. | 1:2:3 |
| A. | 第三周期ⅥA族 | B. | 第二周期ⅥA族 | C. | 第三周期ⅣA族 | D. | 第二周期ⅣA族 |
| R | |||
| T | Q | W |
| A. | 原子半径:T>Q>R | |
| B. | 最简单气态氢化物的还原性:R>Q | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
| A. | H2b+n-8ROb | B. | HnROb | C. | H8-nROb | D. | H2b-n-8ROb |
| A. | HCl稳定性比HI好 | |
| B. | CH4的沸点比NH3的沸点低 | |
| C. | Mg失电子能力比Ca弱 | |
| D. | NaCl与NH4Cl含有的化学键类型完全相同 |