题目内容
16.有关铝的几个实验如下.请填写下列空白.实验一 毛刷实验
实验过程如图1.
(1)配制Hg(NO3)2溶液时,为抑制水解,需加入少量的硝酸.
(2)铝导线放NaOH溶液的目的是除去表面的氧化膜,其化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
(3)生成白色毛状物的实质是铝发生电化腐蚀生成A12O3,其中作正极材料的是d
(填序号).
a.O2 b.A1 c.Hg(NO3)2 d.Hg
实验二 探究白色毛状物是否含有结晶水
取适量白色毛状物样品放入仪器X称量,质量为m1 g
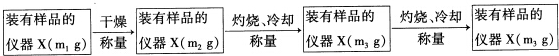
(4)图2中仪器X应选用以下哪个装置坩埚(填名称).
(5)上述过程中“冷却“时要在图3所示的装置中进行的原因是防止在冷却过程中吸收空气中的水.
(6)根据所得实验资料,能说明白色毛状物含结晶水的证据是m2>m3(用代数式表示).
实验三 验证A12 O3对石蜡油裂解的催化作用按图4连好装置,检查装置的气密性,加入5~6g Al2O3,加热到500℃左右,往Al2O3上滴入石蜡油.已知:石蜡油为液态烷烃混合物(与汽油类似),沸点164~223℃.一定条件下,其裂解产物为乙烯和烷烃的混合物.
(7)使用装置B的目的是将挥发出来的石蜡油冷却,防止对溴水进行萃取,干扰乙烯的检验.
(8)需要再补充一个实验才能证明Al2O3对石蜡油裂解反应有催化作用,请简述其实验方案:不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用.
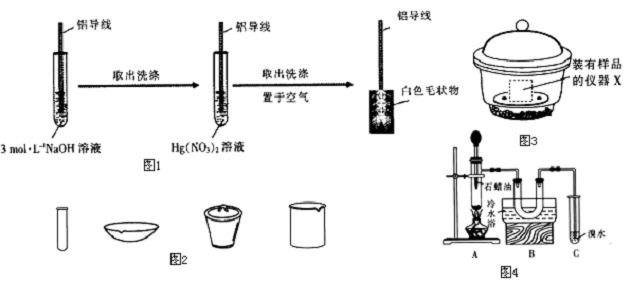
分析 (1)硝酸汞水解生成氢氧化汞和硝酸,加酸抑制其水解;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(3)铝与硝酸汞置换生成汞,汞、Al与电解质溶液形成原电池,活泼性弱的金属作正极;
(4)灼烧固体在坩埚中进行;
(5)为了防止固体吸收空气中的水,一般在干燥器中冷却;
(6)加热前后固体的质量不同,说明固体中含有结晶水;
(7)石蜡受热有部分挥发,挥发的石蜡会干扰乙烯的检验;
(8)加氧化铝或不加氧化铝,两种情况下作对比实验.
解答 解:(1)硝酸汞水解生成氢氧化汞和硝酸,加酸抑制其水解,为了避免引入杂质,所以要加硝酸来抑制其水解,故答案为:硝酸;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,其反应的方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(3)铝与硝酸汞置换生成汞,汞、Al与电解质溶液形成原电池,活泼性弱的金属作正极,则正极为汞,故答案为:d;
(4)把固体样品放入仪器中灼烧,灼烧固体在坩埚中进行,故答案为:坩埚;
(5)灼烧后的固体应该放在干燥器中冷却,以防止固体吸收空气中的水,故答案为:防止在冷却过程中吸收空气中的水;
(6)加热前后固体的质量不同,说明加热时固体失去了结晶水,即m2>m3,则说明固体中含有结晶水,故答案为:m2>m3;
(7)已知石蜡油为液态烷烃混合物(与汽油类似),沸点164~223℃,而石蜡的分解温度为500℃左右,反应温度高于石蜡的沸点,则会有部分石蜡挥发,挥发的石蜡,进入溴水会发生萃取,而使溴水褪色,因此会干扰乙烯的检验,所以用冷水冷却挥发出来的石蜡;
故答案为:将挥发出来的石蜡油冷却,防止对溴水进行萃取,干扰乙烯的检验;
(8)要证明Al2O3对石蜡油裂解反应有催化作用,应该在加氧化铝或不加氧化铝,两种情况下作对比实验,不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用,
故答案为:不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用.
点评 本题考查了探究物质的组成、原电池原理的应用、物质的性质、催化剂催化作用的探究等,题目涉及的知识点较多,题目综合性强,侧重于考查学生的对基础知识的综合应用能力和实验探究能力.

①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
| A. | ②一①一④一③一⑤ | B. | ②一④一①一③一⑤ | C. | ①一③一⑤一②一④ | D. | ③一①一②一⑤一④ |
| A. | 用锌粒和稀硝酸反应制备H2 | B. | 用NH4NO3加热制取NH3 | ||
| C. | 大理石与稀硫酸反应制备CO2 | D. | 用焰色反应鉴别固体NaCl和 KCl |

| A. | 迷迭香酸与溴单质只能发生取代反应 | |
| B. | 1 mol迷迭香酸最多能和8mol氢气发生加成反应 | |
| C. | 迷迭香酸不能发生取代反应和消去反应 | |
| D. | 1 mol迷迭香酸最多能与6 mol NaOH发生反应 |
 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.