题目内容
18.(1)已知:O2(g)═O+2(g)+e-△H1=1175.7kJ•mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)═O2+(g)+PtF6-△H3=482.2kJ•mol-1
则反应O2(g)+PtF6(g)═O2+PtF6-(s)△H=-77.6 kJ•mol-1 kJ•mol-1
(2)由C和S形成的液态化合物CS2,0.2mol/l CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
(3)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”),H2A的电离方程式为H2A?H++HA-,该溶液中由水电离出的c(H+)=10-10mol/L.
(4)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a> b(填“>”、“<”或“=”,下同).
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a< b.
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a> b.
分析 (1)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
(2)0.2mol CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ,即可得出1mol二硫化碳完全燃烧生成稳定氧化物放出的热量,从而写出热化学方程式.
(3)在水溶液里只有部分电离的酸是弱酸,二元弱酸分步电离,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度.
(4)①当两种酸的物质的量浓度相同时,应注意醋酸是弱酸,不完全电离.
②在pH相同、体积相同的两种酸溶液中,两种酸的物质的量不同,故反应结束时生成H2的总体积会不同.
③醋酸是弱酸,存在电离平衡,加水稀释,引起电离平衡的移动.
解答 解:(1)已知:①O2(g)=O2+(g)+e-△H1=+1175.7kJ•mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ•mol-1
③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJ•mol-1,
故答案为:-77.6 kJ•mol-1;
(2)0.2mol CS2在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,则1mol二硫化碳完全燃烧生成稳定氧化物放出的热量为1075kJ,则热化学反应方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol;
(3)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A?H++HA-,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)水=c(OH)=10-10 mol/L,
故答案为:弱;H2A?H++HA-;10-10 mol/L;
(4)①当两种酸的物质的量浓度相同时,由于盐酸是强酸,完全电离,醋酸是弱酸,不完全电离,故c(H+):a>b,
故答案为:>;
②由于盐酸是强酸,完全电离,醋酸是弱酸,不完全电离,故当pH相同、体积相同时,需要c(CH3COOH)>c(HCl),即n(CH3COOH)>n(HCl),故反应结束时生成H2的总体积a<b,
故答案为:<;
③设原来的pH均为m,将盐酸溶液分别加水稀释100倍后,由于盐酸为强酸,故pH变为m+2;而醋酸是弱酸,存在电离平衡,加水稀释,引起电离平衡向右移动,H+减小的幅度较小,故pH<m+2,故两者关系为:a>b,
故答案为:>.
点评 本题考查了盖斯定律、热化学方程式的书写以及弱电解质电离平衡的移动,题目难度中等,试题知识点较多、综合性较强,充分考查学生灵活应用基础知识的能力.

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器体积),可增加单位体积内活化分子数,从而使反应速率增大 | |
| C. | 活化分子间所发生的碰撞为有效碰撞 | |
| D. | 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子数 |
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
| A. | 用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 | |
| B. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
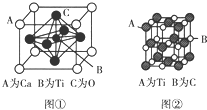 钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
 .
.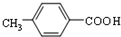 ②
②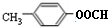
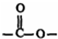 基团.
基团. .
.