题目内容
10.下列说法不正确的是( )| A. | 用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 | |
| B. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
分析 A.根据价层电子对互斥理论确定分子或离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型;
B.分子晶体中一定存在分子间作用力,但是其中可能含有共价键,可能没有;
C.原子晶体中非金属原子之间的作用力为共价键,Si原子能形成4个共价键;
D.CCl2F2无同分异构体,说明分子为四面体结构,根据价层电子对互斥理论确定空间构型,据此判断.
解答 解:A.H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(3-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,故A正确;
B.分子晶体中一定存在分子间作用力,不一定存在共价键,如惰性气体组成的晶体中不含化学键,只含有分子间作用力,故B正确;
C.原子晶体中非金属原子之间的作用力为共价键,SiO2晶体中每个硅原子与4个氧原子形成4个Si-O共价键,故C错误;
D.CCl2F2中心原子碳原子价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化,说明分子为四面体结构,CCl2F2无同分异构体,故D正确;
故选C.
点评 本题考查价层电子对互斥理论、共价键等,侧重于杂化轨道理论的理解应用的考查,题目难度中等,注意相关知识的积累.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
| A. | 石灰水 | B. | 空气 | C. | 生铁 | D. | 水 |
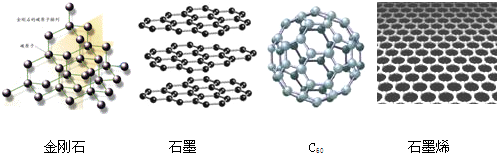
| A. | 金刚石和石墨烯中碳原子的杂化方式不同 | |
| B. | 金刚石、石墨、C60 和石墨烯的关系:互为同素异形体 | |
| C. | 这四种物质完全燃烧后的产物都是CO2 | |
| D. | 石墨与C60的晶体类型相同 |
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| B. | 碳酸钙与盐酸反应:CaCO3+2 H+→Ca2++CO2↑+H2O | |
| C. | 锌粉溶解于醋酸:Zn+2 H+→Zn2++H2↑ | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
 ,下列有关木糖醇的叙述中不正确的是( )
,下列有关木糖醇的叙述中不正确的是( )| A. | 1mol木糖醇与足量钠反应最多可产生2.5molH2 | |
| B. | 木糖醇是一种单糖,不能发生水解反应 | |
| C. | 木糖醇易溶解于水,能发生酯化反应 | |
| D. | 糖尿病患者可以食用 |
| A. | 化学键是两个原子之间的相互作用力 | |
| B. | 若形成新化学键释放的能量大于断裂旧化学键吸收的能量,则该化学反应是放热反应 | |
| C. | 某些吸热反应不加热也可能发生反应 | |
| D. | 氮气在通常状况下化学性质很稳定,是因为其分子内部的共价键很难被破坏 |