题目内容
13.下列说法不正确的是( )| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器体积),可增加单位体积内活化分子数,从而使反应速率增大 | |
| C. | 活化分子间所发生的碰撞为有效碰撞 | |
| D. | 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子数 |
分析 一般来说,增大浓度、压强只能改变单位体积的活化分子的数目,而百分数不变,但升高温度、加入催化剂等,可增大活化分子百分数,从而导致反应速率增大.
解答 解:A.增大浓度,单位体积活化分子数目增多,则使有效碰撞次数增大,反应速率加快,但百分数不变,故A错误;
B.气体参加的反应,增大压强,单位体积活化分子数目增多,从而使反应速率增大,故B正确;
C.活化分子之间发生碰撞,且发生化学变化时的碰撞才是有效碰撞,故C错误;
D.升高温度,提供分子需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,故D错误.
故选B.
点评 本题考查影响反应速率的因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.以下操作会使结果偏高的是( )
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
4.使用单质铜制取硝酸铜,最适宜的方法是:( )
| A. | Cu+稀HNO3 | B. | Cu空气、△→空气、△→CuO硝酸→硝酸→Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | CuCl2→Cl2→CuCl2AgNO3→AgNO3→Cu(NO3)2 |
1.下列物质中,属于纯净物的是( )
| A. | 石灰水 | B. | 空气 | C. | 生铁 | D. | 水 |
8.许多城市都限制燃放烟花爆竹,除噪声污染外,爆竹燃放时会产生一种无色有刺激性气味、有毒的气体,这种气体是( )
| A. | N2 | B. | SO2 | C. | CO2 | D. | C12 |
5.2010年诺贝尔物理奖授予发现石墨烯的开创性研究者,金刚石、石墨、C60和石墨烯的结构示意图分别如下图所示,下列说法不正确的是( )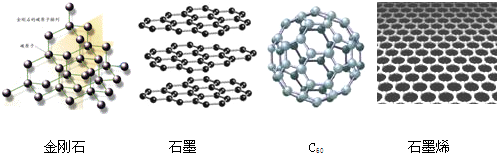

| A. | 金刚石和石墨烯中碳原子的杂化方式不同 | |
| B. | 金刚石、石墨、C60 和石墨烯的关系:互为同素异形体 | |
| C. | 这四种物质完全燃烧后的产物都是CO2 | |
| D. | 石墨与C60的晶体类型相同 |
19.下列离子反应方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| B. | 碳酸钙与盐酸反应:CaCO3+2 H+→Ca2++CO2↑+H2O | |
| C. | 锌粉溶解于醋酸:Zn+2 H+→Zn2++H2↑ | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
20.如图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )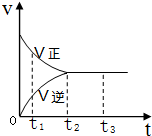

| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应表面静止 | D. | t2-t3,各物质的浓度不再发生变化 |