题目内容
13.(1)如图1,在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3g NaHCO3和0.3g Na2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口.将气球内的NaHCO3和Na2CO3同时倒入试管中,请回答下列问题:
①试管Ⅰ和试管Ⅱ中发生反应的离子方程式分别为HCO3-+H+═CO2↑+H2O、CO32-+2H+═CO2↑+H2O.
②加入固体后,试管Ⅰ(填“Ⅰ”或“Ⅱ”)上的气球膨胀较快.
(2)为了研究Na2CO3、NaHCO3与盐酸的反应过程中的热效应,该同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后的最高温度 |
| ① | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ④ | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
①该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究.
②通过上述实验可得出:
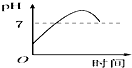
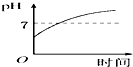
Na2CO3溶液和盐酸的反应是放热(填“吸热”或“放热”,下同)反应,对应的图象
为B(见图2)NaHCO3溶液和盐酸的反应是吸热反应,对应的图象为A.
分析 (1)①碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,据此书写;
②NaHCO3和Na2CO3与盐酸反应在同一条件下的速率不同,碳酸氢钠反应速率更快;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;
②a.由实验②、④反应中溶液温度变化判断碳酸钠与盐酸的反应中能量变化;
b.由实验①、③中温度变化判断碳酸氢钠与盐酸反应的能量变化.
解答 解:(1)①碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式为:HCO3-+H+═CO2↑+H2O,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式为:CO32-+2H+═CO2↑+H2O,故答案为:HCO3-+H+═CO2↑+H2O;CO32-+2H+═CO2↑+H2O;
②装有NaHCO3溶液的试管中很快产生气泡,而装有Na2CO3溶液的试管中开始没有气泡产生,但随着滴入稀盐酸的量增加,才会产生气泡,
故答案是:Ⅰ;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应,则该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究,
故答案为:碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究;
②a.由实验②、④可知,碳酸钠与盐酸的反应后溶液的温度升高,可知该反应过程中放热热量,则碳酸钠与盐酸的反应为放热反应,反应物的总能量大于生成物的总能量,所以B符合,故答案为:放热;B;
b.由实验①、③可知,当NaHCO3与盐酸反应后,混合溶液的温度降低,说明碳酸氢钠与盐酸的反应为吸热反应,反应物的总能量小于生成物的总能量,所以A符合,
故答案为:吸热;A;
点评 本题以实验探究考查碳酸钠、碳酸氢钠的性质及与酸反应的热效应,题目难度中等,把握表格中实验数据的分析为解答的关键,注意变量控制法的应用.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
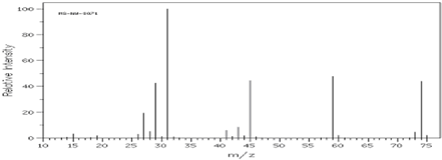
| A. | 74 | B. | 31 | C. | 59 | D. | 45 |
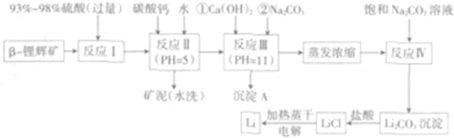
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(2)反应Ⅱ中加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)洗涤所得Li2O3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 8 | 1s22s22p4 | 2s22p4 | 第二周期 | ⅥA |
| 24 | 1s22s22p63s23p63d54s1 | 3d54s1 | 第四周期 | ⅥB |
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属 |