题目内容
12.已知某KOH样品中含水7.62%、含 K2CO32.38%、含KOH90%,现将1.00g样品加入46.00mL 1.00 mol/L的盐酸中,过量的酸用1.070mol/L的KOH中和,蒸发溶剂,蒸发到无水时,可得到的固体的质量为( )| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
分析 样品和稀盐酸反应生成KCl,剩余的酸和KOH反应生成KCl,所以反应后溶液中的溶质是KCl,蒸发溶液最后得到的溶质是KCl,根据Cl原子守恒计算得到固体质量.
解答 解:样品和稀盐酸反应生成KCl,剩余的酸和KOH反应生成KCl,所以反应后溶液中的溶质是KCl,蒸发溶液最后得到的溶质是KCl,根据Cl原子守恒得n(KCl)=n(HCl)=1.00mol/L×0.046L=0.046mol,则m(KCl)=0.046mol×74.5g/mol=3.43g,故选B.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确最后得到固体成分是解本题关键,再结合原子守恒解答即可,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
4.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA | |
| B. | 1L 0.1mol醋酸溶液中所含分子数少于0.1NA | |
| C. | 水分子中1mol羟基含有的电子总数为9NA | |
| D. | 1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
3.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
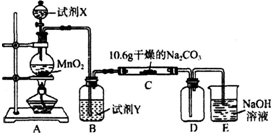
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.

(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.
20.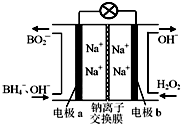 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
7.标准状况下,将VLH2S气体通入a Lb mo l/L的 NaOH 溶液中,下列对所得溶液的描述不正确的是( )
| A. | 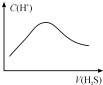 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
17.下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 +Cl2+H2O=HCO-3+Cl-+HClO | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO2-4先形成沉淀. |
4.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
 写出B的化学式Fe2O3
写出B的化学式Fe2O3