题目内容
1.现有中学化学常见的物质,其中甲、乙、丙是单质,甲为第三周期金属,A、B、C、D、E、F是化合物,B是红棕色气体,C在常温下是无色无味液体,甲元素的原子序数是丙元素原子序数的2倍,它们之间有如图所示的相互转化关系(部分反应条件已略去).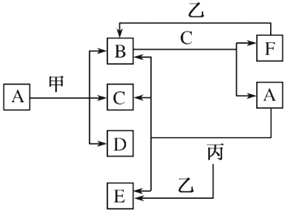
(1)B的化学式为NO2,D的化学式为Mg(NO3)2.
(2)写出A与丙反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(3)工业上制取A分三步进行,其中两步反应已经在图中得到体现,写出另外一步反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)若9.6g甲与一定量A浓溶液完全反应后,生成标准状况下的8.96L气体中含有的B和F,且甲无剩余,则B和F的物质的量之比为1:1.
分析 B是红棕色气体,B是NO2;C在常温下是无色无味液体,则C为H2O,甲为第三周期金属,甲元素的原子序数是丙元素原子序数的2倍,甲的原子序数为偶数,则原子序数为12,即甲为Mg,则丙为C;结合转化可知,A溶液是浓硝酸,则D为Mg(NO3)2,B与C生成F,F为NO,F与乙生成B,则乙为O2,由丙和A的反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O可知,E为CO2,以此来解答.
解答 解:B是红棕色气体,B是NO2;C在常温下是无色无味液体,则C为H2O,甲为第三周期金属,甲元素的原子序数是丙元素原子序数的2倍,甲的原子序数为偶数,则原子序数为12,即甲为Mg,则丙为C;结合转化可知,A溶液是浓硝酸,则D为Mg(NO3)2,B与C生成F,F为NO,F与乙生成B,则乙为O2,由丙和A的反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O可知,E为CO2,
(1)由上述分析可知,B为NO2,D为Mg(NO3)2,故答案为:NO2;Mg(NO3)2;
(2)A与丙反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)制取A分三步进行,氨气的催化氧化、NO氧化生成二氧化氮、二氧化氮与水反应生成硝酸,则除图中转化外的另外一步反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)n(Mg)=$\frac{9.6g}{24g/mol}$=0.4mol,8.96L气体中含有的B和F,气体的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,Mg完全反应,设B和F的物质的量分别为x、y,由电子守恒及原子守恒可知,$\left\{\begin{array}{l}{x+y=0.4}\\{x+3y=0.4×2}\end{array}\right.$,解得x=0.2mol,y=0.2mol,所以B和F的物质的量之比为1:1,故答案为:1:1.
点评 本题考查无机物的推断,为高频考点,把握N及其化合物、Mg及其化合物的性质、相互转化为解答的关键,侧重分析与推断能力的考查,(4)中氧化还原反应计算为解答的难点,题目难度中等.

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案| A. | 酸性高锰酸钾 | B. | 溴水 | C. | 液溴 | D. | NaOH溶液 |
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的结构式:
 ;
;(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
| A. | 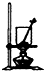 将海带灼烧成灰 | B. | 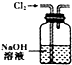 除去氯气中的HCl | C. |  实验室制取NO | D. | 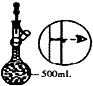 配制溶液过程 |
| A. | 钠块在乙醇的液面上游动 | B. | 钠块并不熔化 | ||
| C. | 钠块沉在乙醇液面下面 | D. | 钠块表面有气体放出 |
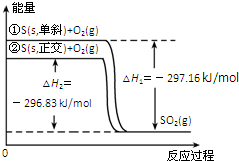
| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
| A. | Cl2、SO2、H2SiO3、NH4Cl | B. | Al、CO、HCl、Al(NO3)3 | ||
| C. | N2、SiO2、CH3COOH、Na2CO3 | D. | Fe CaO、NH3H2O NaHCO3 |