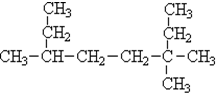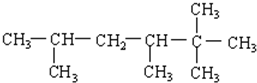题目内容
7.标准状况下,将VLH2S气体通入a Lb mo l/L的 NaOH 溶液中,下列对所得溶液的描述不正确的是( )| A. | 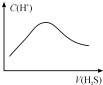 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
分析 当n(NaOH):n(H2S)≥2时,发生反应H2S+2NaOH=Na2S+2H2O,当n(NaOH):n(H2S)≤1时,发生反应H2S+NaOH=NaHS+H2O,当1<n(NaOH):n(H2S)<2时,两个反应都发生,酸或碱抑制水电离,含有弱根离子的盐促进水电离.
解答 解:当n(NaOH):n(H2S)≥2时,发生反应H2S+2NaOH=Na2S+2H2O①,当n(NaOH):n(H2S)≤1时,发生反应H2S+NaOH=NaHS+H2O②,当1<n(NaOH):n(H2S)<2时,
A.随着硫化氢的通入,反应①发生,硫化钠促进水电解,但反应②发生时,由于生成NaHS的水解能力小于硫化钠的水解能力,导致由水电离产生氢离子浓度有所降低,反应②发生完全后,硫化氢过量,由水电离产生的氢离子浓度降低更大,故A正确;
B.当$\frac{V}{22.4}$=a b时,发生反应②,溶液中的溶质是NaHS,根据物料守恒得c(Na+)=c(S2-)+c(HS-)+c(H2S),根据电荷守恒得c(OH-)+2c(S2-)+c(HS-)=c(H+)+c(Na+),所以得c(OH-)+c(S2-)=c(H+)+c(H2S),故B正确;
C.当$\frac{V}{11.2}$=a b时,发生反应①,溶液中的溶质是Na2S,硫离子部分水解生成HS-,硫离子两步水解都生成氢氧根离子,所以溶液呈碱性,且c(OH-)>c(HS-),则离子浓度大小顺序为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故C正确;
D.当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,①完全反应,②部分反应,生成Na2S、NaHS,NaHS溶液中存在c(Na+)=c(S2-)+c(HS-)+c(H2S),Na2S溶液中存在c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),所以在Na2S、NsHS混合溶液中不存在c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误;
故选D.
点评 本题考查了酸碱混合溶液定性判断、离子浓度大小比较,题目难度中等,明确物质间发生的反应是解本题关键,再结合物料守恒、电荷守恒来分析解答.

| A. | 庚烷 | B. | 新戊烷 | C. | 正戊烷 | D. | 2-甲基丁烷 |
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量氢氧化钠溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4 gNaOH时误用了“左码右物”方法 |
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的结构式:
 ;
;(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
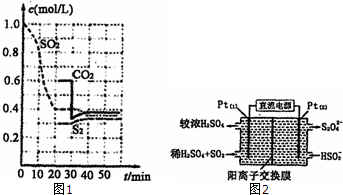 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.