题目内容
20.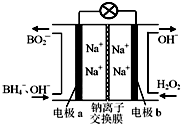 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
分析 由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:A.BH4-被氧化为BO2-,应为原电池的负极反应,正极H2O2得电子被还原生成OH-,原电池工作时,阳离子向正极移动,则电池放电时Na+从a极区移向b极区,故A错误;
B.BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故B正确;
C.电极b采用MnO2,MnO2作电极材料,为正极,还可起到催化作用,故C错误;
D.每消耗3molH2O2,转移的电子为6mol,故D错误.
故选B.
点评 本题考查原电池的工作原理,本题注意根据物质化合价的变化判断两极反应为解答该题的关键,注意电极反应式的书写,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.现有三组混合溶液:①乙酸乙酯和乙酸钠溶液 ②1-丁醇和乙醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
13.可用来鉴别己烯、四氯化碳、苯的方法是( )
| A. | 酸性高锰酸钾 | B. | 溴水 | C. | 液溴 | D. | NaOH溶液 |
8. 硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.
硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图.
①还原炉中发生主要反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.该工艺中可循环使用的物质为HCl和H2(填化学式).用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$ SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4遇空气和水都不稳定.但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185°C的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2.
①由SiCl4和NH3反应制取Si3N4的化学方程式为3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
③Si3N4和适量氧化镁在230×1.01×105Pa和185°C的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成SiO2物质(填化学式).热处理后除去MgO和Mg3N2的方法是加足量稀盐酸过滤.
 硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.
硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图.
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si+2CO↑ |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4遇空气和水都不稳定.但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185°C的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2.
①由SiCl4和NH3反应制取Si3N4的化学方程式为3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
③Si3N4和适量氧化镁在230×1.01×105Pa和185°C的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成SiO2物质(填化学式).热处理后除去MgO和Mg3N2的方法是加足量稀盐酸过滤.
5.以下实验或操作不能达到目的是( )
| A. | 用溴水鉴别苯、乙醇、四氯化碳 | |
| B. | 准确称取4.0 gNaOH溶于9 6 mL水得质量分数为4.0%的溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| D. | 用激光笔检验淀粉溶液的丁达尔现象 |
12.已知某KOH样品中含水7.62%、含 K2CO32.38%、含KOH90%,现将1.00g样品加入46.00mL 1.00 mol/L的盐酸中,过量的酸用1.070mol/L的KOH中和,蒸发溶剂,蒸发到无水时,可得到的固体的质量为( )
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
9.乙醇、乙二醇、丙三醇分别与足量金属钠反应产生等体积的H2(相同状况下),则上述三种醇物质的量之比为( )
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
10.单斜硫和正交硫转化为二氧化硫的能量变化图如所示.下列说法正确的是( )
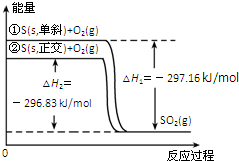

| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.