��Ŀ����
3��ij��ѧ�С�������ͼ��ʾ�����ּг�װ������ȥ��ʵ��װ�ã���̽����ʪ��Cl2��Na2CO3��Ӧ�õ��Ĺ������ʣ�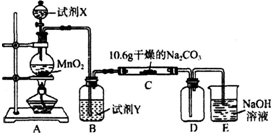
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ��MnO2+4H++2Cl- $\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��2��д���Լ�Y�����ƣ�����ʳ��ˮ��
��3����֪��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壬��Ϊ�������������ȷ������C�к��е�����ֻ��һ�֣��Һ���NaHCO3���ֶ�C�ɷֽ��в����̽����
������������裺
����һ���������ֳɷ֣�NaHCO3��NaCl��
��������������ֳɷ֣�NaHCO3��NaCl��Na2CO3��
����Ʒ���������ʵ�飮��д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ��ɲ���������
��ѡʵ���Լ�������������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ���Թܡ�С�ձ���
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡC�е�����������Ʒ���Թ��У��μ� ��������ˮ�������ܽ⣬Ȼ��������Һ�ֱ�����A��B�Թ��У� | |
| ����2����A�Թ��еμ�BaCl2��Һ | ��������������֤�������в���̼���ƣ� ������Һ����ǣ�֤�������к���̼���ƣ� |
| ����3����B�Թ��еμӹ�����ϡ���ᣬ�ٵμ�AgNO3��Һ | ����Һ����ǣ���ϲ���2�еĢ٣������ һ��������ϲ���2�еĢڣ������������� |
��5��������Na2CO3��NaHCO3��Ϊ0.1mol/L�Ļ����Һ�У�c��OH-��-c��H+��=$\frac{3}{2}$c��H2CO3��+$\frac{1}{2}$c��HCO3-��-$\frac{1}{2}$c��CO32-�����ú�̼Ԫ�ص�����Ũ�ȱ�ʾ�����ڸ���Һ�еμ�ϡ����������ʱ����Һ�����ʵijɷ���NaCl��NaHCO3��
���� ��1������������Ũ�����ڼ��������������������Ȼ��̺�ˮ��
��2���Ʊ������к����Ȼ������壬�Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ�����Ҫ�ñ���ʳ��ˮ��ȥ�Ȼ��⣻
��3����װ��C��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壨�����������C�к���Ԫ�ص���ֻ��һ�֣��Һ���NaHCO3��
����������ֳɷ֣�ΪNaHCO3��NaCl��
����������ֳɷ֣�Ӧ����δ��ȫ��Ӧ��Na2CO3������NaHCO3��NaCl��Na2CO3��
����2����A�Թ��еμ�����BaCl2��Һ���Ǽ���������Ƿ���Na2CO3��
����3Ӧ�Ǽ��������ӣ�Ӧ��B�Թ��еμӹ�����ϡ���ᣬ�ٵμ�AgNO3��Һ������Һ����ǣ�֤�������к���NaCl��
��4������������ԭ��Ӧ�����غ�����ж���Ԫ�ػ��ϼ�д�������ﻯѧʽ�����ݷ�Ӧ�����������ƽ��д��ѧ����ʽ��
��5������̼���ƺ�̼��������Һ�д��ڵ������غ����ʽ������
�����Ⱥ�̼���Ʒ�Ӧ������̼�����Ʒ���ʽΪ��Na2CO3+HCl=NaHCO3+NaCl��̼�������ٺ����ᷴӦ������CO2
����ʽΪ��NaHCO3+HCl=NaCl+CO2��+H2O����ȫ��Ӧ��CO2����ˮ�����ԣ���Һ�����ԣ�˵��NaHCO3�����ԣ�Ӧ��ʣ�࣮
��� �⣺��1��ʵ�����ö������̺�Ũ���������������ӷ���ʽ��MnO2+4H++2Cl- $\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl- $\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��2���Ʊ������к����Ȼ������壬��Ҫ�ñ���ʳ��ˮ��ȥ���ʴ�Ϊ������ʳ��ˮ��
��3������װ��C��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壨�����������C�к���Ԫ�ص���ֻ��һ�֣��Һ���NaHCO3��
����������ֳɷ֣�ΪNaHCO3��NaCl��
����������ֳɷ֣�Ӧ����δ��ȫ��Ӧ��Na2CO3������NaHCO3��NaCl��Na2CO3��
�ʴ�Ϊ��NaCl��NaCl��Na2CO3��
�ڲ���2����A�Թ��еμ�����BaCl2��Һ���Ǽ���������Ƿ���Na2CO3��
����3Ӧ�Ǽ��������ӣ�Ӧ��B�Թ��еμӹ�����ϡ���ᣬ�ٵμ�AgNO3��Һ������Һ����ǣ�֤�������к���NaCl��
�ʴ�Ϊ��BaCl2��Һ��������ϡ���ᣬ�ٵμ�AgNO3��Һ��
��4��C����0.1mol Cl2�μӷ�Ӧ��װ��C��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壬������һ��������ӦΪCl2+Na2CO3��NaHCO3+NaCl+X������������ԭ��Ӧ�����غ�����ж���Ԫ�ػ��ϼ�Ϊ+1�ۣ�����֪C�з�Ӧ���ɵĺ���������ΪCl2O����Ӧ�Ļ�ѧ����ʽΪ��2Cl2+H2O+2Na2CO3�T2NaHCO3+2NaCl+Cl2O��
�ʴ�Ϊ��2Cl2+H2O+2Na2CO3�T2NaHCO3+2NaCl+Cl2O��
��5�����������غ㣬����Na2CO3��Һ�У�c��OH-��=c��H+��+2c��H2CO3��+c��HCO3-����NaHCO3��Һ�У�c��OH-��+c��CO32-��=c��H+��+c��H2CO3�������ߵ�Ũ�ȡ��������Ϻ���Һ���������ʵ����ʵ�����ȣ����ԣ���������ʽ���ӣ�[c��OH-��=c��H+��+2c��H2CO3��+c��HCO3-��]+[c��OH-��+c��CO32-��=c��H+��+c��H2CO3��]���������2c��OH-��-2c��H+��=3c��H2CO3��+c��HCO3-��-c��CO32-����
c��OH-��-c��H+��=$\frac{3}{2}$c��H2CO3��+$\frac{1}{2}$c��HCO3-��-$\frac{1}{2}$c��CO32-����
�����Ⱥ�̼���Ʒ�Ӧ������̼�����Ʒ���ʽΪ��Na2CO3+HCl=NaHCO3+NaCl��̼�������ٺ����ᷴӦ������CO2
����ʽΪ��NaHCO3+HCl=NaCl+CO2��+H2O����ȫ��Ӧ��CO2����ˮ�����ԣ���Һ�����ԣ�˵��NaHCO3�����ԣ�Ӧ��ʣ�࣬������Һ�����ʵijɷ֣�NaCl��NaHCO3��
�ʴ�Ϊ��$\frac{3}{2}$c��H2CO3��+$\frac{1}{2}$c��HCO3-��-$\frac{1}{2}$c��CO32-����NaCl��NaHCO3��
���� ����Ϊ�ۺ��⣬������������ʵ�����Ʊ����Լ������Ļ�ѧ���ʡ����ӵļ���֪ʶ�������ˮ��ƽ�⡢����ƽ�⣬��Ŀ�Ѷ��еȣ������������ʺ�ʵ����Ʒ����ǽ���ؼ���

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| A�� | ͼ�ж�Ӧ����¶ȹ�ϵΪ��a��b��c | |
| B�� | ��ˮ�������¶ȣ��ɴ�a��䵽c�� | |
| C�� | ˮ�ĵ��볣��KW��ֵ��С��ϵΪ��b=d��c | |
| D�� | ��b���Ӧ�¶��£���pH=2��H2SO4��pH=10��NaOH��Һ�������Ϻ���Һ������ |
| A�� | 16O2��18O2��Ϊͬ���칹�� | |
| B�� | 16O��18O��������Ų���ʽ��ͬ | |
| C�� | ͨ����ѧ�仯����ʵ��16O��18O����ת�� | |
| D�� | 1.12 L 16O2��1.12 L 18O2����0.1NA����ԭ�� |
| A�� | ���Ը������ | B�� | ��ˮ | C�� | Һ�� | D�� | NaOH��Һ |
 �輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣮
�輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣮��1���ߴ������ִ���Ϣ���뵼��������Ȳ�ҵ����Ҫ�Ļ������ϣ���ҵ���ᴿ���ж���·�ߣ�����һ�ֹ�������ʾ��ͼ����Ҫ��Ӧ��ͼ��
| ��������Ҫ��Ӧ | |
| �绡¯ | SiO2+2C$\frac{\underline{\;1600-1800��\;}}{\;}$Si+2CO�� |
| ��������Ӧ�� | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| ��ԭ¯ |
������������Ӧ�IJ����У�SiHCl3��Լռ85%������SiCl4��SiH2Cl2��SiH3Cl�ȣ��й����ʵķе��������±����ᴿSiHCl3����Ҫ���ղ��������dz����������;�������
| ���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| �е�/��C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
��2�������裨Si3N4����һ�ָ��½ṹ���ϣ���ĩ״̬��Si3N4������SiCl4��������NH3��Ӧ��ȡ����ĩ״Si3N4��������ˮ�����ȶ���������ĩ״��Si3N4����������þ��230��1.01��105Pa��185��C���ܱ������н����ȴ����������Ƶýṹʮ�ֽ��ܡ��Կ�����ˮ���൱�ȶ��Ĺ�����ϣ�ͬʱ���õ���ˮ���ȶ���Mg3N2��
����SiCl4��NH3��Ӧ��ȡSi3N4�Ļ�ѧ����ʽΪ3SiCl4+4NH3$\frac{\underline{\;����\;}}{\;}$Si3N4+12HCl��
�����Ȼ���͵������������ձ����£���ǿ�ȷ�����Ӧ��ʹ���ɵ�Si3N4������ʯī����ɵýϸߴ��ȵĵ����裬�÷�Ӧ�Ļ�ѧ����ʽΪ3SiCl4+2N2+6H2$\frac{\underline{\;����\;}}{\;}$Si3N4+12HCl��
��Si3N4����������þ��230��1.01��105Pa��185��C���ܱ������н����ȴ����Ĺ����У�������Mg3N2�⣬����������SiO2���ʣ��ѧʽ�����ȴ������ȥMgO��Mg3N2�ķ����Ǽ�����ϡ������ˣ�
| A�� | 3.00g | B�� | 3.43g | C�� | 4.50g | D�� | ������ |
| A�� | �ƿ����Ҵ���Һ�����ζ� | B�� | �ƿ鲢���ۻ� | ||
| C�� | �ƿ�����Ҵ�Һ������ | D�� | �ƿ����������ų� |
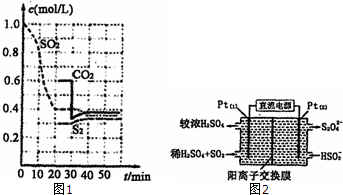 ���ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�ã���SO2ֱ���ŷŻ�Ի������Σ����
���ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�ã���SO2ֱ���ŷŻ�Ի������Σ����