题目内容
19.X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
分析 X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,应是氢氧化铝与强碱、强酸的反应,故X为Na、Y为Al;Z的单质具有半导体的特性,则Z为Si;W原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故W为S,则R为Cl,据此解答.
解答 解:X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,应是氢氧化铝与强碱、强酸的反应,故X为Na、Y为Al;Z的单质具有半导体的特性,则Z为Si;W原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故W为S,则R为Cl.
A.X与氧元素形成的化合物有氧化钠、过氧化钠,过氧化钠中含有离子键、共价键,故A正确;
B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故第三周期元素的简单离子中Al3+离子的半径最小,故B正确;
C.Z、W的氧化物为二氧化硅、二氧化硫(或三氧化硫),均为酸性氧化物,故C正确;
D.应是元素最高价含氧酸的酸性:R>W,不是最高价含氧酸则不一定,如次氯酸为弱酸,而硫酸为强酸,故D错误,
故选:D.
点评 本题考查位置结构性质关系应用,关键是明确元素种类,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.用眠表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |
4.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )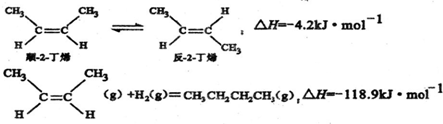

| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: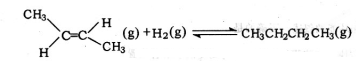 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
11.下列有关实验叙述正确的是( )
| A. | 除去苯中混有少量的苯酚可加人浓溴水后过滤 | |
| B. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液裉色,说明维生素C具有还原性 | |
| C. | 在淀粉溶液中加稀硫酸并加热后,加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 将Na2SO3溶液蒸干,灼烧至恒重,最终剩余固体是Na2SO3 |
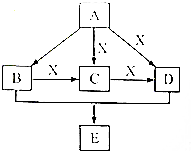
8. 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
9.如图所示装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的是( )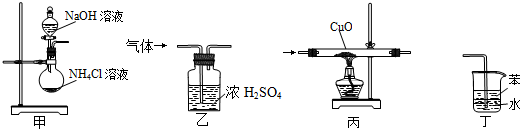

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
 A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题:
A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题: ,工业上大量获得A的方法是石油裂解.
,工业上大量获得A的方法是石油裂解. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;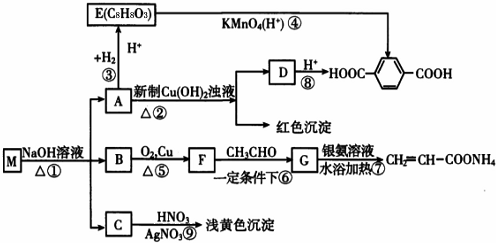
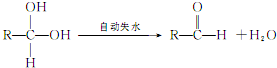
 ;
; ;
; ;
;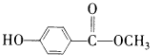 ,
,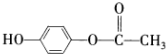 ?
?