题目内容
8.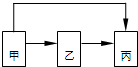 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
分析 A、若甲是Al,丙是Al(NO3)3,乙可以是铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,可以是偏铝酸钠和过量硝酸反应生成硝酸铝;
B、若甲是Al2O3,丙是NaAlO2,乙可以是和盐酸反应生成的氯化铝,氯化铝和过滤氢氧化钠溶液反应得到偏铝酸钠;
C、甲是Al(NO3)3,丙是NaAlO2,乙只能是Al(OH)3 和氢氧化钠反应生成偏铝酸钠;
D、若甲是Al(OH)3,丙是Al(NO3)3,乙可以是氢氧化铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝;
解答 解:A、若甲是Al,丙是Al(NO3)3,乙可以是铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,可以是偏铝酸钠和过量硝酸反应生成硝酸铝,乙不一定是NaAlO2,故A错误;
B、若甲是Al2O3,丙是NaAlO2,乙可以是和盐酸反应生成的氯化铝,氯化铝和过量氢氧化钠溶液反应得到偏铝酸钠,也可以是硫酸铝和过量氢氧化钠溶液反应得到偏铝酸钠,故乙不一定是Al(NO3)3,故B错误;
C、甲是Al(NO3)3,丙是NaAlO2,乙只能是两性化合物Al(OH)3 和氢氧化钠反应生成偏铝酸钠,故C正确;
D、若甲是Al(OH)3,丙是Al(NO3)3,乙可以是氢氧化铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,也可以是氢氧化铝溶于氢氧化钠溶液生成的偏铝酸钠,偏铝酸钠和过量硝酸反应得到硝酸铝,故D错误;
故选C.
点评 本题考查了铝及其化合物性质的分析应用,注意氢氧化铝、氧化铝是两性化合物既可以和强酸反应也可以和强碱溶液反应,掌握实质是关键,题目难度中等.

练习册系列答案
相关题目
19.X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
16.乙烷与氯气在光照条件下发生取代反应所得有机物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
17.亚硝酸钠(NaNO2)是一种常用的防腐剂,有咸味,易溶于水,有毒.在320℃时分解生成有刺激性气味的气体,与盐酸作用会放出红棕色气体.亚硝酸钠在食品中的添加量必须严格控制.下列说法不正确的是( )
| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
18.化学与科技、生产、生活密切相关.下列说法正确的是( )
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 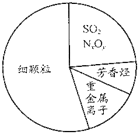 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
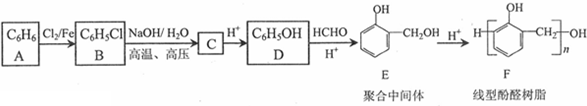
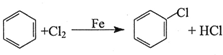 ,反应类型为取代反应
,反应类型为取代反应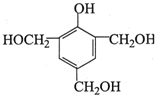
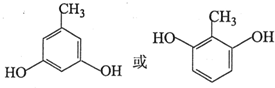 (写出其中一种的结构简式);
(写出其中一种的结构简式);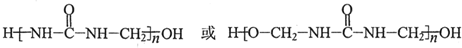 .
.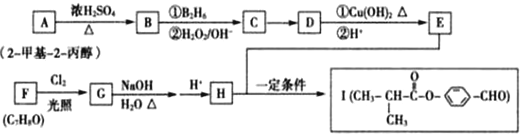
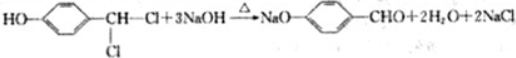 .
.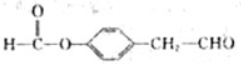 、
、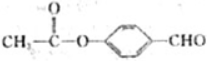 .
.