题目内容
10.用眠表示阿伏加德罗常数的值.下列叙述中正确的是( )| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |
分析 A.气体摩尔体积适用对象为气体;
B.Na2O中含2个Na+和1个O2-,Na2O2中含2个Na+和1个O22-;
C.甲基(-14C1H3)中含有8个中子、9个电子,1mol该甲基中含有8mol中子、9mol电子;
D.溶液体积未知,无法计算饱和碳酸镁溶液中含Mg2+数目.
解答 解:A.标况下,水为液体,不能使用气体摩尔体积,故A错误;
B.Na2O中含2个Na+和1个O2-,Na2O2中含2个Na+和1个O22-,故当两者物质的量相等时,所含的阴离子数目相等,故B错误;
C.1mol甲基(-14C1H3)中含有8mol中子、9mol电子,所含的中子数和电子数分别为8NA、9NA,故C正确;
D.溶液体积未知,无法计算饱和碳酸镁溶液中含Mg2+数目,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件;掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
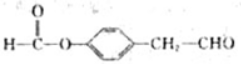
1.根据反应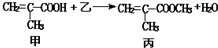 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )
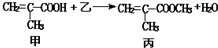 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )| A. | 乙物质为甲醇 | |
| B. | 该反应为取代反应 | |
| C. | 甲与乙都能与金属钠反应产生氢气 | |
| D. | 甲、乙、丙都能与溴的四氯化碳溶液发生加成反应 |
5.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 航天服材质是由碳化硅、陶瓷和碳纤维等复合而成,它是一种新型有机合成材料 | |
| B. | 煤中含有苯、二甲苯等,可以通过煤的干馏得到,并将它们分离 | |
| C. | 经过一定的化学变化,可以从海水中提取氯化钠、镁、溴等 | |
| D. | 在海轮外壳镶嵌锌块,能减缓轮船的腐蚀,是利用牺牲阳极的阴极保护法 |
15.三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是
( )
| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
2.常温下,满足甲组中的任意一种物质均能与乙组中任意一种物质发生反应的是( )
| 选项 | 甲组 | 乙组 |
| A | Al(OH)3、稀盐酸 | NaOH溶液、氨水 |
| B | O2、N2 | H2、Mg |
| C | Cu、NaOH溶液 | FeCl3溶液、稀硝酸 |
| D | SiO2、Cl2 | HF、H2SO3 |
| A. | A | B. | B | C. | C | D. | D |
19.X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
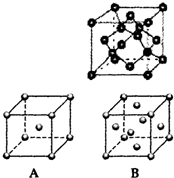 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题: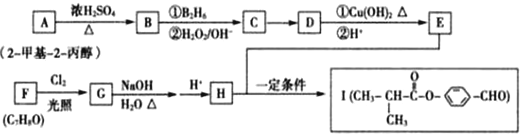
 .
. 、
、 .
.