题目内容
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
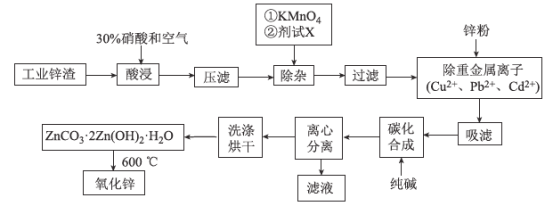
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
【答案】将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等 ZnO[或Zn(OH)2或ZnCO3] 4.7≤pH<6.0 除去Mn2+ 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ Fe(OH)3、Al(OH)3、MnO2 3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3] 静置,取少许上层清液继续滴加纯碱溶液,若无沉淀产生,则证明纯碱过量(或静置,取少许上层清液滴加CaCl2溶液,若有白色沉淀产生,则证明纯碱过量)
【解析】
(1)根据增大固体反应物接触面积,升高温度,增大反应物浓度等角度分析;
(2)根据除杂的同时不要掺入新的杂质考虑;根据流程及表中数据,确定pH的范围;
(3)加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+;
(4)由(2)、(3)知“过滤”所得滤渣;
(5)“碳化合成”时加入Na2CO3,产物为ZnCO3 2Zn(OH)2H2O,写出化学方程式;
(6)若Na2CO3不足,检验溶液中的Zn2+;Na2CO3过量时,可检验溶液中的CO32-;
(1)酸浸的主要目的是将ZnO等物质与硝酸反应,为加快反应速率,可采取的方法有加热、将将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等;
答案:将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等
(2)加入试剂X的目的是调节溶液的pH,使Fe3+、Al3+生成沉淀除去,为不引入新的杂质离子,可加入ZnO、Zn(OH)2、ZnCO3等,根据流程及表中数据,需调节pH的范围为4.7≤pH<6.0;
答案:4.7≤pH<6.0
(3)加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+,反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
答案:除去Mn2+ 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
(4)由(2)、(3)知,“过滤”所得滤渣的主要成分是Fe(OH)3、Al(OH)3、MnO2;
答案:Fe(OH)3、Al(OH)3、MnO2
(5)“碳化合成”时加入Na2CO3,产物为ZnCO3 2Zn(OH)2H2O,反应的化学方程式为3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3];
答案:3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3]
(6)若Na2CO3不足时,溶液中还有Zn(NO3)2,继续滴加Na2CO3溶液,有沉淀产生;Na2CO3过量时,可检验溶液中的CO32-;
答案:静置,取少许上层清液继续滴加纯碱溶液,若无沉淀产生,则证明纯碱过量(或静置,取少许上层清液滴加CaCl2溶液,若有白色沉淀产生,则证明纯碱过量)

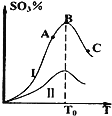
【题目】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__%(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
时间/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
则鼓风炉中CO总的转化率为___;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P) ____?