题目内容
【题目】银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题:
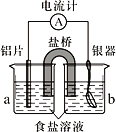
(1)铝为________极,KNO3盐桥中的________离子进入a烧杯中,银器的电极反应式为________。
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极的电极反应式是_________,总反应方程式_______
【答案】负 ![]() Ag2S+2e-=2Ag+S2- Al-3e-=Al3+ 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
Ag2S+2e-=2Ag+S2- Al-3e-=Al3+ 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
【解析】
铝片、表面变黑的银质器皿、食盐溶液构成原电池,由于铝的金属活动性比银强,所以铝片作负极,银器皿作正极。在负极,铝失电子生成铝离子,为中和电性,盐桥中的阴离子进入负极区溶液中;在正极,银表面的硫化银得电子生成银和硫离子,为中和电性,盐桥中的阳离子进入正极区溶液中。原电池反应发生后,若将两溶液混合,则负极生成的铝离子与正极生成的硫离子会发生双水解反应。
(1)因为铝的金属活动性比银强,所以铝为负极,电极反应为Al-3e-=Al3+,为中和电性,KNO3盐桥中的![]() 离子进入a烧杯中,银器表面Ag2S得电子,生成Ag和S2-,电极反应式为Ag2S+2e-=2Ag+S2-。答案为:负;
离子进入a烧杯中,银器表面Ag2S得电子,生成Ag和S2-,电极反应式为Ag2S+2e-=2Ag+S2-。答案为:负;![]() ;Ag2S+2e-=2Ag+S2-;
;Ag2S+2e-=2Ag+S2-;
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极为Al失电子生成Al3+,电极反应式是Al-3e-=Al3+,正极为Ag2S+2e-=2Ag+S2-,两电极产生的离子能发生双水解反应,生成H2S和Al(OH)3,总反应方程式为3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓。答案为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓。

【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
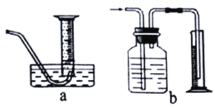
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。