题目内容
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
【答案】7.14 mol/L > 32 0.2 0.66(或66%) 22.35g
【解析】
(1)根据c=![]() 计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)发生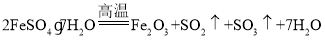 ,结合n=
,结合n=![]() 及反应计算;
及反应计算;
(3)先根据溶液的pH计算剩余硫酸的物质的量,再根据方程式计算氧化铁的质量,根据质量分数公式计算氧化铁的质量分数;
(4)根据原子守恒计算生成硫酸亚铁的物质的量及莫尔盐的物质的量,根据析出的晶体计算溶液中莫尔盐的质量,再根据![]() ,计算其溶解度。
,计算其溶解度。
(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为c=![]() mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
(2)n(FeSO47H2O)=![]() =0.4mol,由
=0.4mol,由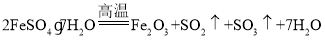 可知,生成Fe2O3的质量为0.4mol×
可知,生成Fe2O3的质量为0.4mol×![]() ×160g/mol=32g,SO2为0.4mol×
×160g/mol=32g,SO2为0.4mol×![]() =0.2mol;
=0.2mol;
(3)根据题意知,稀释溶液至100mL,测得其pH=1,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×![]() ×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。设铁的物质的量是m,氧化铁的质量是n,发生反应的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,则根据固体的质量和硫酸的物质的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以铁屑中Fe2O3的质量分数是
×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。设铁的物质的量是m,氧化铁的质量是n,发生反应的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,则根据固体的质量和硫酸的物质的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以铁屑中Fe2O3的质量分数是![]() ×100%=0.66(或66%);
×100%=0.66(或66%);
(4)根据以上结合原子守恒知,n(FeSO4)=n(Fe)+2n(Fe2O3)=(0.03+0.04)mol=0.07mol,根据莫尔盐的化学式知,n[(NH4)2SO4·FeSO4·6H2O]= n(FeSO4)=0.07mol,溶液中莫尔盐的质量为0.07mol×392g/mol-12.360g=15.08g,设莫尔盐的溶解度为x,则![]() =
=![]() ,解得x=22.35g。
,解得x=22.35g。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案