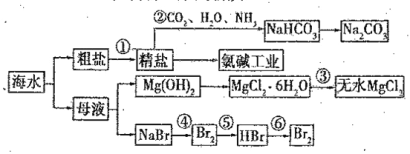
题目内容
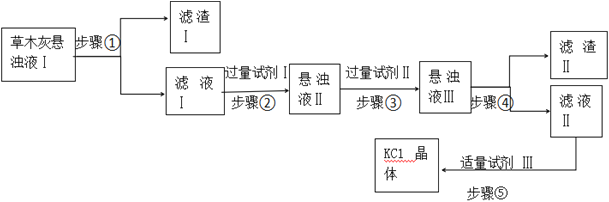
【题目】草木灰主要成分是K2CO3、KCl、K2SO4和不溶于水的杂质。化学实验组为了制取KCl晶体,设计了如下流程。
 回答下列问题:
回答下列问题:
(1)步骤①中用到的玻璃仪器为:烧杯、_____________。
(2)试剂Ⅲ的名称是__________,步骤⑤操作的名称是________。 可供选择的试剂:BaCl2溶液、Ba(NO3)2溶液、K2CO3溶液、Na2CO3溶液、盐酸。步骤②选择的试剂Ⅰ是___________,发生反应的离子方程式为______________;步骤③选择的试剂Ⅱ是__________,其作用是______________。
【答案】漏斗、玻璃棒 盐酸 蒸发、结晶 BaCl2溶液 Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓ K2CO3溶液 除去过量BaCl2
【解析】
草木灰主要成分是K2CO3、KCl、K2SO4和不溶于水的杂质,为了提纯KCl,过滤除去不溶性杂质,加入试剂Ⅰ是过量BaCl2溶液除去K2CO3、K2SO4,再加入过量试剂Ⅱ是K2CO3,除去过量BaCl2,过滤得到沉淀Ⅱ为BaCO3、BaSO4,滤液Ⅱ中加入试剂Ⅲ为盐酸,除去过量碳酸钾,得到溶液氯化钾溶液,通过加热蒸发,结晶析出得到氯化钾晶体,蒸发到有大量晶体析出,停止加热,靠余热蒸干剩余水得到氯化钾晶体,以此解答该题。
(1)步骤①为过滤操作,用到的玻璃仪器为:烧杯、漏斗、玻璃棒;
(2)试剂Ⅲ应为盐酸,用于除去过量的碳酸钾,步骤⑤由溶液得到晶体,为蒸发、结晶操作,由以上分析可知步骤②选择的试剂Ⅰ是BaCl2溶液,发生反应的离子方程式为Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓;步骤③选择的试剂Ⅱ是K2CO3溶液,其作用是除去过量BaCl2。

【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关