题目内容
【题目】I.某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
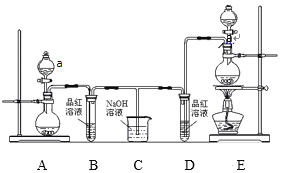
(1)仪器a的名称是 _________。
(2)利用图中E装置进行实验室制备Cl2的离子方程式是_________。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______________。
(4)装置C的作用是_____________。
II.该小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
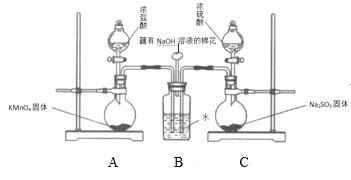
其中装置A制取氯气,装置C制取SO2:
(1)甲同学认为若SO2和Cl2反应,则应有Cl-生成,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量_________溶液,有白色沉淀生成。
(2)乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有的试剂是_________。
(3)丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
(4)丙同学取BaCl2溶液于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中能相互发生反应,反应的化学方程式是_______。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 溶液由无色变为红色 吸收多余的氯气和二氧化硫,防止污染环境 AgNO3 饱和食盐水 Cl2和水反应也会生成Cl- SO2+Cl2+2H2O=2HCl+H2SO4
Mn2++2H2O+Cl2↑ 溶液由无色变为红色 吸收多余的氯气和二氧化硫,防止污染环境 AgNO3 饱和食盐水 Cl2和水反应也会生成Cl- SO2+Cl2+2H2O=2HCl+H2SO4
【解析】
I.在A中用浓硫酸与亚硫酸钠反应制取SO2气体,在B中验证SO2的漂白性,在E中制取Cl2,在装置D中验证Cl2水溶液的漂白性,在装置C中吸收多余Cl2、SO2气体。
II.装置图分析可知装置A是制备氯气的发生装置,装置C是制备二氧化硫的发生装置,氯气和二氧化硫通入装置B中的水,SO2和Cl2在水中反应生成硫酸和盐酸,据此解答。
I. (1)根据图示可知仪器a的名称是分液漏斗;
(2)利用图中E装置进行实验室制备Cl2的反应,MnO2与浓盐酸加热产生MnCl2、Cl2、H2O,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
(3)Cl2溶于水,与水反应产生盐酸和次氯酸,次氯酸的漂白性是利用次氯酸的强氧化性,次氯酸的漂白性是永久性的。二氧化硫的漂白性是利用二氧化硫和有色物质结合生成无色物质,二氧化硫的漂白性是暂时的,所以停止通气后,给B、D两支试管中的液体加热,试管中现象是:B试管恢复红色;D试管仍为无色;
(4)Cl2、SO2都是大气污染物,直接排放会造成大气污染,装置C的作用是吸收多余SO2、Cl2,防止污染空气。
II. (1)根据Ag++Cl-=AgCl↓沉淀来检验Cl-,所以加入是试剂是AgNO3溶液;
(2)由于浓盐酸具有挥发性,所以在制备氯气中含有杂质氯化氢和水蒸气,氯化氢进入B中溶于水也会生成氯离子,乙同学认为Cl2中混有的杂质是HCl,需要在AB间增加一个洗气瓶,可以用饱和食盐水除去;
(3)Cl2与水反应的化学方程式为Cl2+H2O![]() HCl+HClO,生成的Cl-,干扰了SO2和Cl2反应产物HCl的检验;
HCl+HClO,生成的Cl-,干扰了SO2和Cl2反应产物HCl的检验;
(4)SO2与Cl2同时通入水中反应为SO2+Cl2+2H2O=2HCl+H2SO4,H2SO4与BaCl2溶液混合,发生复分解反应产生HCl、BaSO4白色沉淀。

【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
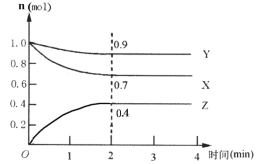
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。