题目内容
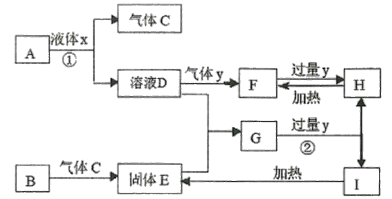
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
【答案】C
【解析】
由现象可知:实验1发生完全双水解反应生成Al(OH)3,实验2过量的Na2CO3与完全双水解反应生成Al(OH)3发生反应。
A. 实验1中,沉淀溶解,无气泡,白色沉淀a是Al(OH)3,故A错误;
B. 实验2中,沉淀溶解,少量气泡,该气体是CO2,但不能说明白色沉淀b一定是Al2(OH)2(CO3)2,故B错误;
C. 检验白色沉淀a、b是否洗涤干净,即可检验有无SO42-,均可用盐酸酸化的BaCl2溶液检验,故C正确;
D. 实验1、2中,过量Al2(SO4)3溶液显酸性,过量Na2CO3溶液显碱性,不能确定白色沉淀成分不同的原因与混合后溶液的pH有关,故D错误;
答案选C。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】乳酸亚铁([CH3CH(OH)COO]2Fe3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe3H2O+CO2↑
FeCO3不溶于水,易被氧化,4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图:
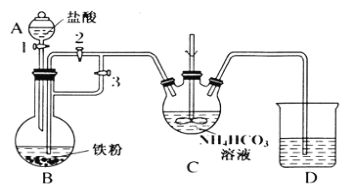
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式_________。
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_____。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。加入少量铁粉的作用是_______。
(4)反应结束后,无需过滤,除去过量铁粉的方法是_________。
(5)从所得溶液中获得乳酸亚铁晶体的方法是:________,冷却结晶,过滤, 用适量乙醇洗涤,干燥。
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是___。
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+=Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500molL-1Ce(SO4)2标准溶液滴定至终点,记录数据如表。
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.20 | 19.95 |
2 | 0.10 | 21.65 |
3 | 0.95 | 20.60 |
则产品中乳酸亚铁的质量分数为________%。(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+:_______。
【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
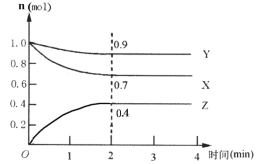
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。