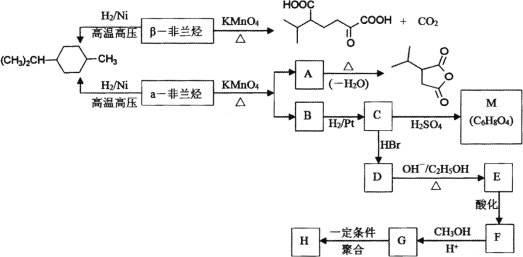
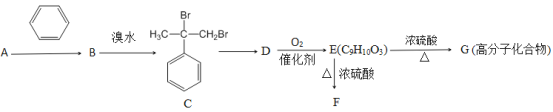
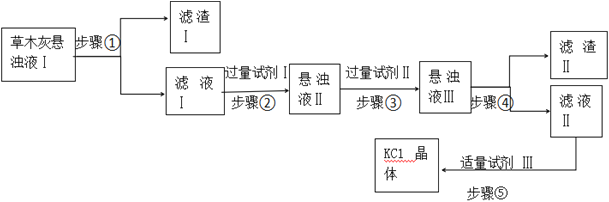
题目内容
【题目】碳酸氢钠用途广泛。可广泛应用于医疗、生活、生产中。回答下列问题:
(1)碳酸氢钠能中和胃酸,碳酸氢钠属于____________(填“酸”“碱”“盐”)
(2)碳酸氢钠能与酒石酸配制固体清凉饮料的发泡剂。将发泡剂溶于水发生反应的离子是_________________。
(3)生活中可用碳酸氢钠蒸馒头,用化学方程式解释其原理__________。将碳酸氢钠加入面团中,若理论上生成二氧化碳0.1mol,需要碳酸氢钠的质量是_______克。
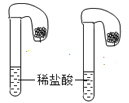
(4)碳酸钠和碳酸氢钠是厨房中常见用品,为鉴别它们,取等质量的样品分别加入如图所示装置的气囊中做对比实验,依据_____________现象,推断哪种样品为碳酸氢钠;写出该反应的离子方程式__________________。
【答案】盐 HCO3-+H+=CO2↑+H2O 2NaHCO3![]() Na2CO3+CO2↑+H2O 16.8 气囊体积大小 HCO3-+H+=CO2↑+H2O、CO32-+2H+=CO2↑+H2O
Na2CO3+CO2↑+H2O 16.8 气囊体积大小 HCO3-+H+=CO2↑+H2O、CO32-+2H+=CO2↑+H2O
【解析】
(1)碳酸氢钠属于盐类;
(2)碳酸氢钠与酸反应产生CO2、H2O;
(3)用碳酸氢钠蒸馒头,涉及碳酸氢钠的分解反应;
(4)等质量时,碳酸氢钠生成的二氧化碳较多,气囊体积较大。
(1)碳酸氢钠电离,生成的阳离子为钠离子,阴离子为酸根离子,属于酸式盐,是盐类;
(2)涉及碳酸氢钠与酸的反应,离子方程式为HCO3-+H+=CO2↑+H2O;
(3)用碳酸氢钠蒸馒头,涉及碳酸氢钠的分解反应,方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O,根据方程式可知生成CO20.1mol,需要0.2molNaHCO3,其质量m(NaHCO3)=0.2mol×84g/mol=16.8g;
Na2CO3+CO2↑+H2O,根据方程式可知生成CO20.1mol,需要0.2molNaHCO3,其质量m(NaHCO3)=0.2mol×84g/mol=16.8g;
(4)等质量时,碳酸氢钠生成的CO2较多,气囊体积较大,涉及反应的离子方程式为HCO3-+H+=CO2↑+H2O、CO32-+2H+=CO2↑+H2O。