题目内容
17.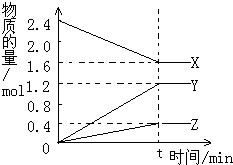 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:①该反应的化学方程式是2X?3Y+Z.
②反应起始至t,Y的平均反应速率是$\frac{0.6}{t}$mol/(L•min).
分析 (1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,得到反应的化学方程式;
(2)在tmin时间内,用Y表示反应的平均速率v(Y)=$\frac{△c}{△t}$.
解答 解:(1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,物质在反应中物质的量之比等于化学方程式计量数之比,则反应的化学方程式为:2X?3Y+Z;
故答案为:2X?3Y+Z;
(2)在tmin时间内,用Y表示反应的平均速率v(Y)=$\frac{△c}{△t}$=$\frac{\frac{1.2mol}{2L}}{tmin}$=$\frac{0.6}{t}$mol/(L﹒min),故答案为:$\frac{0.6}{t}$mol/(L﹒min).
点评 本题考查物质的量或浓度随时间的变化曲线 化学反应速率变化曲线及其应用,涉及化学方程式、平衡状态、反应速率的计算等问题,题目难度不大,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.反应N2+3H2?2NH3,开始时N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,3min后测得NH3浓度为0.6mol•L-1,则此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
2.能够充分说明在恒温下的密闭容器中,反应 2SO2+O2?2SO3 已经达到平衡状态的标志是( )
| A. | 容器中SO2、O2和SO3共存 | |
| B. | SO2和SO3的物质的量浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应器内压强不再随时间发生变化 |
9.在检验溶液中SO42-的过程中,下列操作中正确的是( )
| A. | 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
6.已知在溶液中IO3-与I-发生反应5I-+IO3-+6H+═3I2↓+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO3-.可供选用的物质有:
①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是( )
①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是( )
| A. | ①③ | B. | ③⑥ | C. | ②④⑥ | D. | ①②④⑤⑦ |
7.如表是元素周期表的一部分,按要求完成各小题.
(1)元素①的元素符号:Na
(2)元素⑧的单质电子式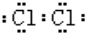
(3)元素⑤的原子结构示意图
(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式
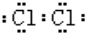
(3)元素⑤的原子结构示意图

(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
 .
.