题目内容
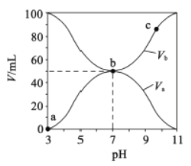
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
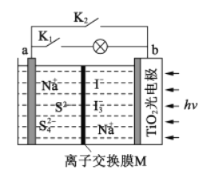
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
【答案】C
【解析】
A.根据题意:TiO2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又转化为化学能,A错误;
B.充电时Na2S4还原为Na2S,放电和充电互为逆过程,所以a是负极,B错误;
C.在充电时,阳极b上失电子,发生氧化反应,根据图示知道电极反应为:3I--2e-═I3-,故C正确;
D.根据图示可以知道交换膜允许钠离子自由通过,所以应该是阳离子交换膜,D错误;
故合理选项是C。

练习册系列答案
相关题目
【题目】已知25℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数/ mol/ L | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列说法正确的是
A. 等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 将等浓度的 HA溶液与NaA溶液等体积混合,混合液中:c(A-)<c(Na+)
C. 向 Na2B溶液中加入足量的 HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D. NaHB溶液中部分微粒浓度的关系为:c(Na+)=c(HB-) +c(H2B)+c(B2-)