��Ŀ����
����Ŀ��I.ijͬѧ�����ͼ��ʾװ��̽�������ܷ���ˮ������Ӧ������a����Ҫ�ɷ��Ǻ�������ˮ��������������ش��������⣺


��1������a����ͼ�����Ʊ� ����ѡ��ͼ�еļ�װ�ã���Ӧ�����ӷ���ʽ��_____����ѡ��װ���ң����еĵ��� a ��������_____��
��2��֤��������ˮ������Ӧ��ʵ������Ϊ_____________��
��3����ʵ����ƴ���ȱ�ݣ�Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D�����з�����Ӧ�����ӷ���ʽΪ_________________��
II.��ͼΪŨ������ͭ��Ӧ�����������ʵ��װ��

�ش��������⣺
��1��ָ���Թ�c�в�����ʵ������______________________��
��2�� �ÿɳ鶯��ͭ˿����ͭƬ���ŵ�___________��
��3��д��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
���𰸡�MnO2+ 4H++2Cl-![]() Cl2��+Mn2++2H2O ƽ����ѹ��ʹ��Һ©���е�Һ����˳������ װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ Cl2+2OH-=Cl-+ClO-+H2O ʯ����Һ���ɫ ���Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ Cu+2H2SO4��Ũ��
Cl2��+Mn2++2H2O ƽ����ѹ��ʹ��Һ©���е�Һ����˳������ װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ Cl2+2OH-=Cl-+ClO-+H2O ʯ����Һ���ɫ ���Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��������
I.(1)��ѡ��ͼ�еļ�װ���Ʊ���������Ӧ�����ӷ���ʽ��MnO2+4H++2Cl- ![]() Mn2++Cl2��+2H2O����ѡ��װ���ң�Ӧ��ѡ�������غ�Ũ���ᷴӦ�����еĵ���a����ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����£��ʴ�Ϊ��MnO2+4H++2Cl-
Mn2++Cl2��+2H2O����ѡ��װ���ң�Ӧ��ѡ�������غ�Ũ���ᷴӦ�����еĵ���a����ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����£��ʴ�Ϊ��MnO2+4H++2Cl- ![]() Mn2++Cl2��+2H2O��ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����£�
Mn2++Cl2��+2H2O��ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����£�
(2)��������������Ư���ԣ�������ˮ��Ӧ��������ʹ����ᣬ����ʽΪ��Cl2+H2O=HCl+HClO�����������Ư���ԣ��ʴ�Ϊ��װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ��
(3)�����ж���Ӧ����β�����������������ŷŵ������У����ü���Һ�����գ�Cl2+2NaOH=NaCl+NaClO+H2O�����ӷ���ʽΪ��Cl2+2OH-=Cl-+ClO-+H2O���ʴ�Ϊ��û��β������װ�ã�Cl2+2OH-=Cl-+ClO-+H2O��
II.(1)�����������Ư���ԣ������Թ�b��Ʒ����Һ��ɫ����������Ϊ����������ܹ���ˮ��Ӧ���������ᣬ�����Թ�c�е�ʯ����Һ�Ժ�ɫ���ʴ�Ϊ��ʯ����Һ�Ժ�ɫ��
(2)ͨ���鶯ͭ˿��������ʱ��ֹ��Ӧ�������˷�ԭ�ϡ�������Ⱦ����IJ������ʴ�Ϊ�����Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ��
(3)ͭ��Ũ�����ڼ��������·�Ӧ���ɶ�������Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4(Ũ) ![]() CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu+2H2SO4(Ũ)
CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu+2H2SO4(Ũ) ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��

 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�����Ŀ���������(K2FeO4)��һ���͡���Ч�����Ķ��ˮ��������
�����ϣ�K2FeO4Ϊ��ɫ���壬����KOH��Һ������ǿ�����ԣ������Ի�������Һ�п��ٲ���O2���ڼ�����Һ�н��ȶ���
��1���Ʊ�K2FeO4��
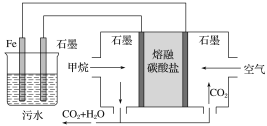
��AΪ��ȡ��������װ�ã�����ʢ��Ũ�������������Ϊ___________��
�ڳ���װ��B�е��Լ�Ϊ___________��
��CΪ�Ʊ�K2FeO4װ�ã�KOH��Һ������ԭ����___________��
��DΪβ������װ�ã�������Ӧ�����ӷ���ʽΪ___________��
��2��̽�� K2FeO4�����ʡ�ȡC����ɫ��Һ������ϡ���ᣬ�����S��ɫ���壬����Һa�������������к���Cl2��Ϊ֤��K2FeO4�ܷ�����Cl��������Cl2��������·�����
����I | ȡ������Һa���μ�KSCN��Һ����������Һ�ʺ�ɫ�� |
������ | ��KOH��Һ���ϴ��C�����ù��壬����KOH��Һ��K2FeO4�ܳ����õ���ɫ��Һb��ȡ����b���μ����ᣬ��Cl2������ |
���ɷ���I����Һ����֪a�к���___________�������ӵIJ���___________(������������������)�ж�һ������K2FeO4��Cl����ԭ���γɵġ�
�ڷ�������KOH��Һϴ�ӵ�Ŀ����___________���������ó������ԣ�Cl2___________FeO42��(����>������<��)
��3��ʹ��ʱ����ͨ���ⶨ������صĴ������ж����Ƿ���ʡ�K2FeO4��������Һ�з�Ӧ������_______ FeO42��+______H+===_______O2��+________Fe3++________(��ƽ������������ӷ���ʽ)________����ȡC��ϴ�Ӳ��������Ʒ������10g������ϡ���ᣬ�ռ���0.672L����(��״����)������Ʒ�и�����ص���������ԼΪ___________��(������������0.1%)