题目内容
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________(填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色)
2HCuCl2(无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
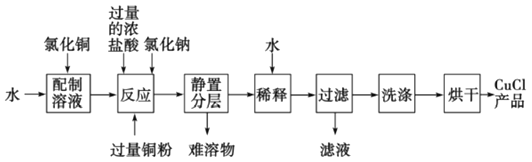
①上述反应流程中,加入氯化钠的目的是________________________。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O![]() CuOH+H+的平衡常数为:________
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________(填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________。
【答案】共价化合物 < 增大Cl-浓度,有利于生成HCuCl2 l d 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl 80.4%
【解析】
(1) CuCl熔融物导电性很差,说明物质中几乎无离子,以分子形式存在,故CuCl为共价化合物;
(2)根据方程式可知:当加入KI溶液少量时发生b反应,产生CuCl沉淀,当加入KI溶液过量时,发生反应a,沉淀为CuI,说明难溶物向更难溶性的物质转化,即Ksp(CuI)<Ksp(CuCl);
(3)①在制备CuCl的过程中加入氯化钠,CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色),增大了Cl-浓度,使化学平衡向生成HCuCl2的方向移动,有利于得到更多的HCuCl2;
2HCuCl2(无色),增大了Cl-浓度,使化学平衡向生成HCuCl2的方向移动,有利于得到更多的HCuCl2;
②常温下,CuOH的Ksp为1.0×10-14,则c(Cu+)c(OH-)=1.0×10-14,c(Cu+)=c(OH-)=1.0×10-7,室温下水的离子积常数为1.0×10-14,所以c(H+)=1.0×10-7。Cu++H2O![]() CuOH+H+的平衡常数为Kh=
CuOH+H+的平衡常数为Kh=![]() ;
;
③CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗涤可以减少CuCl的损失,合理选项是d;
④CuCl在潮湿的环境中与H2O、O2反应产生Cu2(OH)3Cl,根据电子守恒、原子守恒,可得反应的化学方程式为4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
n (CuCl2)= 0.5mol/L×0.002L=0.001mol,根据Cl元素守恒,可得n[CuCl]=0.002mol,理论上得到CuCl质量为m[CuCl]=0.002mol×98.95g/mol=0.1978g,实际产生0.16g,所以实验的产率为![]() 80.4%。
80.4%。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案