题目内容
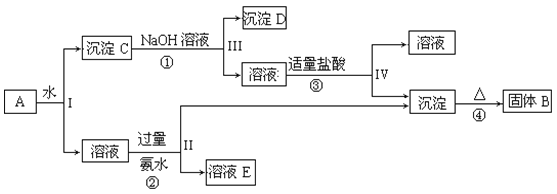
【题目】实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是____________(填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。
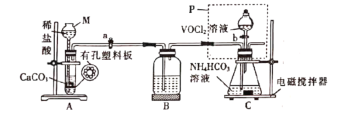
①仪器M的名称是___________,实验开始前的操作是_________。
②装置B的作用是__________________。
③加完VOCl2溶液后继续搅拌一段时间,使反应完全,再进行下列操作,顺序为_______(填字母)。
a.锥形瓶口塞上橡胶塞
b.取下P
c.将锥形瓶置于干燥器中,静置过夜
④得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是_______(填离子符号),用无水乙醇洗涤的目的是_______________。
⑤称量![]() 产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为
产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为![]() +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________(填“偏高”“偏低”或“无影响”),产品中钒的质量分数为_________(以VO2+的量进行计算,列出计算式)。
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________(填“偏高”“偏低”或“无影响”),产品中钒的质量分数为_________(以VO2+的量进行计算,列出计算式)。
【答案】N2H4·2HCl 长颈漏斗 检查装置的气密性 除去二氧化碳气体中的氯化氢 bac Cl- 除去晶体表面的水 偏高 ![]()
【解析】
根据合成氧钒(Ⅳ)碱式碳酸铵晶体流程,将V2O5通过盐酸、N2H4·2HCl的作用,还原为VOCl2,得到的VOCl2与碳酸氢铵溶液同时搅拌将得到氧钒(Ⅳ)碱式碳酸铵晶体;VOCl2转化为氧钒(Ⅳ)碱式碳酸铵晶体的过程如装置图所示,向反应体系中持续通入CO2,CO2溶于水生成碳酸,碳酸电离生成氢离子抑制了铵根离子的水解,保证氧钒(Ⅳ)碱式碳酸铵产率的最大化,反应完成后,将得到的晶体经洗涤、过滤、干杂得到较纯晶体,通过滴定的方法测定晶体中V的含量,据此分析。
(1)反应过程中稀盐酸起到酸性的作用,N2H4·2HCl在反应中起到还原剂的作用;
(2)①根据图示装置,仪器M为长颈漏斗;实验开始前要检查装置的气密性;
②装置B的作用是除去制备的二氧化碳气体中含有氯化氢气体,否则氯化氢与碳酸氢铵会发生反应,降低晶体产率;
③加完VOCl2继续搅拌一段时间,此时需要将分液漏斗取出并密封锥形瓶,目的是防止氧气从分液漏斗中进入锥形瓶,使VO2+被锥形瓶中的氧气持续氧化,减少产量,将密封好的锥形瓶放在干燥器中静置过夜,保证锥形瓶中的反应进行彻底,故正确的顺序为bac;
④根据生成物的晶体组成分析,晶体中不含有Cl-,故用饱和NH4HCO3溶液洗涤可除去的阴离子主要是Cl-,减少晶体的溶解;乙醇能与水互溶,利用乙醇具有挥发性可以除去晶体表面的水分;
⑤若(NH4)2Fe(SO4)2标准溶液部分变质,则还原能力降低,滴定时消耗的标准溶液的体积偏高,会使测定结果偏高;根据滴定反应![]() +Fe2++2H+=VO2++Fe3++H2O,钒元素的物质的量n=n[(NH4)2Fe(SO4)2]=c mol/L×V×10-3L=cV×10-3mol,产品中钒(以VO2+计)的质量分数为
+Fe2++2H+=VO2++Fe3++H2O,钒元素的物质的量n=n[(NH4)2Fe(SO4)2]=c mol/L×V×10-3L=cV×10-3mol,产品中钒(以VO2+计)的质量分数为![]() 。
。

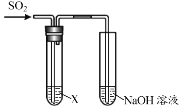
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。
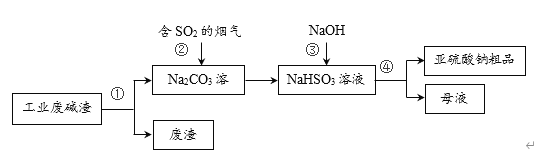
【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。