题目内容
【题目】乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
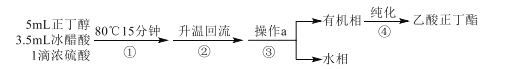
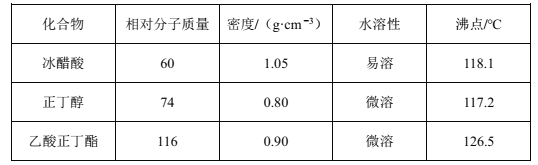
已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。

回答下列问题:
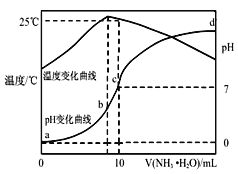
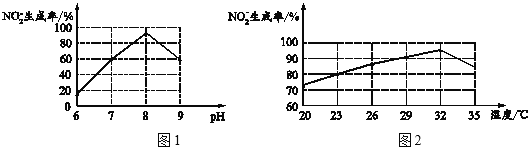
(1)仪器甲的名称是___。步骤①在80℃反应时温度计水银球置于___(填“a”或“b”)处。
(2)使用分水器能提高酯的产率,原因是___(用平衡移动原理解释)。
(3)步骤②观察到___(填标号)现象时,酯化反应已基本完成。
A.当分水器中出现分层 B.分水器中有液体回流至烧瓶
C.分水器水层高度不再变化 D.仪器甲有液体滴落
(4)若反应前分水器中加水不足,会导致___,使产率偏低。
(5)步骤③操作a的名称是___。
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10%Na2CO3溶液的目的是除去___。乙酸正丁酯的产率为___%。
【答案】球形冷凝管 b 分水器能分离出产物中的水,将未反应的正丁醇回流到烧瓶,使平衡向生产酯的方向移动,提高酯的产率 C 回流时正丁醇不能全部返回到烧瓶 分液 混在产品中的硫酸和醋酸 74
【解析】
正丁醇、冰醋酸、浓硫酸80℃反应15分钟,加入碎瓷片防止爆沸,得到乙酸正丁酯,再提高温度使反应处于回流状态,分水器能分离出产物中的水,将未反应的正丁醇回流到烧瓶, 再将液体分液得到乙酸正丁酯和水,再将乙酸正丁酯纯化可得到产品,据此分析。
(1)仪器甲的名称是球形冷凝管,由于反应在蒸馏烧瓶中进行,反应的温度在80℃,温度计水银球应置于b处;
(2)使用分水器能提高酯的产率,原因是分水器能分离出产物中的水,将未反应的正丁醇回流到烧瓶,使平衡向生产酯的方向移动,提高酯的产率;
(3)A.当分水器中出现分层,说明开始产生乙酸正丁酯,不能确定酯化反应已完成,故A不符合题意;
B.分水器中有液体回流至烧瓶,说明开始产生乙酸正丁酯,不能确定酯化反应已完成,故B不符合题意;
C.分水器水层高度不再变化 ,证明酯化反应已完成,不再产生酯了,故C符合题意;
D.仪器甲有液体滴落,说明分水器中的液体在冷凝回流,不能确定酯化反应已完成,故D不符合题意;
答案选C。
(4)若反应前分水器中加水不足,回流时正丁醇不能全部返回到烧瓶,会导致使产率偏低;
(5)步骤③操作a的名称是分液,用于分离互不相溶的液体,经分液得到乙酸正丁酯和水;
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,醋酸的沸点与乙酸正丁酯的相差不大,硫酸难挥发,未反应的硫酸也会和醋酸一起留在蒸馏烧瓶中,加入10%Na2CO3溶液的目的是除去混在产品中的硫酸和醋酸;已知加入5mL丁醇和3.5mL冰醋酸,根据m=ρV计算得到冰醋酸和正丁醇的质量分别为m(CH3COOH)=3.5mL×1.05g/mL=3.675g,m (CH3CH2CH2CH2OH)=0.8g/mL×5mL=4g,根据化学反应:

通过计算可知,醋酸过量,正丁醇完全反应,利用正丁醇计算乙酸丁酯的质量,设乙酸正丁酯的质量为x,

![]() ,解得x=6.27g
,解得x=6.27g
乙酸正丁酯的产率为![]() 74%。
74%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案