题目内容
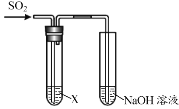
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。
【答案】溶液由紫色变为红色 漂白性 SO42- SO2+2OH- =SO32-+H2O,吸收SO2防止环境污染
【解析】
(1) 二氧化硫为酸性氧化物,溶于水生成压力算,溶液显酸性;
(2) 二氧化硫具有漂白性,能够使品红溶液褪色;
(3) 根据氧化还原反应中化合价变化分析;
(4)二氧化氮有毒,需要用碱液吸收。
(1) 二氧化硫为酸性氧化物,溶于水生成亚硫酸,溶液显酸性,能使紫色石蕊变为红色;
(2) SO2能够使品红溶液褪色,说明SO2具有漂白性;
(3) 高锰酸钾具有强氧化性,能将SO2氧化,S元素从+4价升高到+6价,且氧化产物为SO42-;
(4) 二氧化硫有毒,需要用碱液吸收,避免污染环境,离子方程式为:SO2+2OH- =SO32-+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
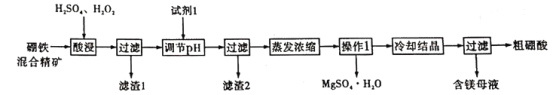
目标测试系列答案【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①②③
实验编号 | HA物质的量浓度/mol L-1 | NaOH物质的量浓度/moL- 1 | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请同答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是(用反应的离子方程式表示)___________________________
(2)在①组游液中下列关系式不正确的是(填序号字母)_______
A.c(Na+)+(H+)=c(OH-) +c(A-)
B.c(Na+ )=c(HA) +c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+)
D. c(Na+)+(H+)=c(OH-) +c(A-)+c(HА)
(3)②组情况表明.c __________0.2 mol L-1(选填“> "、"<"或"="),混合溶液中离子浓度c(A-)________________c(Na+ )(选填“>"、"<"或=")
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“>"、“<"或“="),离子浓度由大到小的顺序是_____________________________________________