题目内容
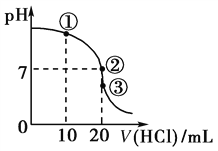
【题目】某同学按下图装置进行实验探究,请回答下列问题:

(1)电能转化为化学能的装置为_______池(填“A”或“B”)。
(2)A装置锌为_______极,实验过程中氢离子浓度较大的是区域______(填“Zn电极”或“Cu电极”)。
(3)B装置石墨2为_______极,电极反应式为_______;当石墨1放出2240mL气体(标准状况下)时,电路中转移电子的数目为_________,若A装置也转移相同数量的电子,锌的质量减少了_______g。
【答案】B 负 铜电极 阴 2H2O+2e-=H2↑+2OH- 0.2NA 6.5
【解析】
A装置为原电池,Zn电极为负极,电极反应为Zn-2e-=Zn2+,Cu电极为正极,电极反应为Cu2++2e-=Cu;B装置为电解池,C1电极为阳极,电极反应为2Cl--2e-=Cl2↑,C2为阴极,电极反应为2H2O+2e-=H2↑+2OH-。
(1)电能转化为化学能的装置为电解池,即B池;
(2)A装置中,Zn作负极;实验过程中,电子从Zn极沿导线流向Cu极,则氢离子在溶液中向正极移动,即向Cu极移动,所以氢离子浓度较大的是区域Cu电极;
(3)B装置中,C2为阴极,电极反应式为2H2O+2e-=H2↑+2OH-;C1电极为阳极,其电极反应为2Cl--2e-=Cl2↑,当C1电极放出Cl2 2240mL(0.1mol)时,电路中转移的电子数目为0.2mol,即0.2NA;若A装置也转移0.2mol的电子,则Zn减少0.1mol,即锌的质量减少了6.5g。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目