��Ŀ����
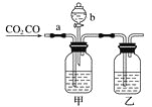
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�ʵ������ȡ����������Ũ����Ͷ�������������������з�Ӧ��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O,�÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢����Ҫ���ȡ����������ѧ֪ʶ�ش���������
(1)�÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ_____________________��
(2)������ͨ����ɫʯ����Һ�У����Թ۲쵽��������________________________________��
(3)ʵ�������ƺ�2.0mol/L NaOH��Һ����Ҫ������Һ____________mL������4.48L��������״����ǡ����ȫ��Ӧ��
(4)��֪Br2��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��NaBr��Һ�л���ͨ��Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ����д����Ӧ�����ӷ���ʽ_________________________________��
(5)����490mL 2.0mol/L NaOH��Һ��
������������������ƹ����������__________________��
������ʵ����Ҫ����������ƽ�������룩��ҩ�ס��ձ�����Ͳ������������ͷ�ιܡ�______________��
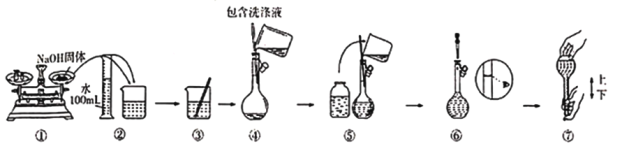
��ijͬѧ�������ƹ�����ͼ��ʾ������Ϊ�д���IJ�����_____________________������������ʾ����ʱ��ָ������ƫ����������ҺŨ�Ƚ�____________________���ƫ�ߡ���ƫ�͡����䡱��
���𰸡�5��1 �ȱ�죬����ɫ 200 Cl2��2Br-��2Cl-��Br2 40.0 g 500 mL����ƿ �٢� ƫ��
��������
��1��KClO3+6HCl =KCl+3Cl2��+3H2O�У�ClԪ�صĻ��ϼ���+5�۽���Ϊ0��ClԪ�صĻ��ϼ��ɩ�1������Ϊ0���Դ������
��2������������ˮ��Ӧ���ɵIJ�������ʹ��������ʷ����жϣ�
��3��n��Cl2����![]() ��0.2mol�����ݷ�Ӧ�����ӷ���ʽCl2+2OH����CIO��+Cl��+H2O���㣻
��0.2mol�����ݷ�Ӧ�����ӷ���ʽCl2+2OH����CIO��+Cl��+H2O���㣻
��4���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ�
��5��������m��nM��cVM���㣻�����ݲ����IJ���ȷ��������������������NaOH����ʱӦ�������룻����ʱӦƽ�ӿ̶��ߣ�����c��![]() ������������
������������
��1��KClO3+6HCl =KCl+3Cl2��+3H2O�У�1KClO3��ClԪ�صĻ��ϼ���+5�۽���Ϊ0����������ΪKClO3��5HCl��ClԪ�صĻ��ϼ��ɩ�1������Ϊ0����ԭ��Ϊ5HCl���������������뻹ԭ�����������֮��Ϊ5��1���ʴ�Ϊ��5��1��
��2������ͨ����ɫʯ����Һ�к�ˮ��Ӧ��������ʹʯ����ɫ�����ɵĴ��������Ư����ʹ��ɫ��ȥ���ʴ�Ϊ���ȱ�죬����ɫ��
��3��n��Cl2����![]() ��0.2mol���ɷ�Ӧ�����ӷ���ʽCl2+2OH����CIO��+Cl��+H2O��֪n��NaOH����0.4mol��V��NaOH����
��0.2mol���ɷ�Ӧ�����ӷ���ʽCl2+2OH����CIO��+Cl��+H2O��֪n��NaOH����0.4mol��V��NaOH����![]() ��0.2L��200mL���ʴ�Ϊ��200��
��0.2L��200mL���ʴ�Ϊ��200��
��4���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ���Ӧ�����ӷ���ʽΪ��Cl2+2Br����2Cl��+Br2��
�ʴ�Ϊ��Cl2+2Br����2Cl��+Br2��
��5��������490mL 2.0molL��1 NaOH��Һ����ѡ��500ml����ƿ������n��NaOH����0.5L��2mol/L��1mol��m��NaOH����1mol��40g/mol��40.0g���ʴ�Ϊ��40.0g��
������˳���ǣ��������������ܽ⡢��ȴ����Һ��ϴ����������ҡ����װƿ��ǩ��һ������ƽ�������õ�ҩ�ף����������ձ����ܽ⣬��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ת����ϣ�����������ˮϴ���ձ���������2��3�β���ϴ��Һȫ��ת�Ƶ�����ƿ�У��ټ���������ˮ������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�ʹ��Һ�İ�Һ�����͵��������ƽ������ƿ�����������µߵ�ҡ�ȡ�������Ҫ��������������ƽ��ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ�����Ҫ500 mL����ƿ���ʴ�Ϊ��500 mL����ƿ��
��������NaOH����ʱӦ�������룬����ʱӦƽ�ӿ̶��ߣ������д���IJ����Ǣ٢ޣ�����������ʾ����ʱ��ָ������ƫ���������NaOH����ƫС������c��![]() ������ҺŨ�Ƚ�ƫ�ͣ��ʴ�Ϊ���٢ޣ�ƫ�͡�
������ҺŨ�Ƚ�ƫ�ͣ��ʴ�Ϊ���٢ޣ�ƫ�͡�

 ��У����ϵ�д�
��У����ϵ�д�