题目内容
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是
A.密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7 mol/L ,则此溶液中K+的物质的量浓度为0.2 mol/L
C.将5 mol/L 的Mg(NO3)2溶液amL 稀释至bmL,稀释后溶液中NO3-的物质的量浓度为![]() mol/L
mol/L
D.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
【答案】A
【解析】
A、依据加水稀释前后溶质的质量不变,该氨水用等体积的水稀释后,所得氨水的质量为水的质量加上原有氨水的质量,所得氨水溶液的溶质为质量分数为25%的氨水中的溶质;
B、由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,溶液呈电中性,根据电荷守恒:3c(Al3+)+c(K+)=2c(SO42﹣);
C、先计算出稀释前硝酸根离子的浓度,然后根据稀释过程中硝酸根离子的物质的量不变计算;
D、根据n=![]() 来计算气体的物质的量,根据m=nM计算气体的质量,根据m=ρV计算水的质量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,根据m=nM计算气体的质量,根据m=ρV计算水的质量,溶剂和溶质的质量和为溶液的质量,利用V=![]() 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c=![]() 来计算该溶液的物质的量浓度。
来计算该溶液的物质的量浓度。
A、设加入水的体积为V,那么质量分数为25%的氨水的体积也为V,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数为:![]() ×100%≈11.9%<12.5%,故A错误;
×100%≈11.9%<12.5%,故A错误;
B、由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,溶液呈电中性,根据电荷守恒:3c(Al3+)+c(K+)=2c(SO42﹣),即3×0.4ol/L+c(K+)=2×0.7mol/L,c(K+)=2×0.7mol/L﹣3×0.4mol/L=0.2mol/L,故B正确;
C、5mol/L的Mg(NO3)2溶液中硝酸根离子的浓度为:5mol/L×2=10mol/L,将a mL该溶液稀释至b mL,稀释过程中硝酸根离子的物质的量不变,稀释后溶液中NO3﹣的物质的量浓度是:![]() =
=![]() mol/L,故C正确;
mol/L,故C正确;
D、气体的物质的量=![]() mol,故气体的质量=
mol,故气体的质量=![]() mol×Mg/mol=
mol×Mg/mol=![]() g,0.1L水的质量为100mL×1g/mL=100g,溶液的质量为(100+
g,0.1L水的质量为100mL×1g/mL=100g,溶液的质量为(100+![]() )g,溶液的体积为
)g,溶液的体积为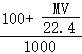 L,所以溶液的物质的量浓度=
L,所以溶液的物质的量浓度=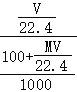 =
=![]() mol/L,故D正确。
mol/L,故D正确。
答案选A。

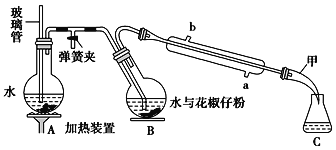
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________。该反应中氧化产物是_____________(填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____(填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________。