题目内容
【题目】CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.01kJmol-1
CH3OH(g)+H2O(g)△H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.17kJmol-1
CO(g)+H2O(g)△H=+41.17kJmol-1
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_____。
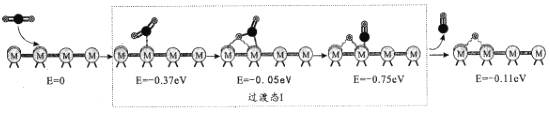
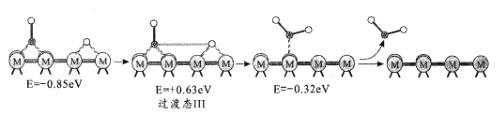
(2)反应iii为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(![]() 为催化剂,
为催化剂,![]() 为C原子,
为C原子,![]() 为O原子,o为H原子)
为O原子,o为H原子)
历程I:
历程II:

历程III:
①历程1方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热△H_____0(填“>”或“<”)。
②反应历程II方框内的方程式是_____。
③反应历程中_____(填“历程I”、“历程II”或“历程III”)是RWGS的控速步骤。
(3)我国科学家研究了不同反应温度对含碳产组成的影响。在反应器中按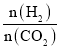 =3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):

①1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_____、_____。M点CO平衡组成含量高于N点的原因是_____。
②当CH4和CO平衡组成为40%时,该温度下反应iii的平衡常数Kp为_____。
【答案】CO(g)+2H2(g)![]() CH3OH(g) △H=-90.18kJmol-1 < O*+H*=OH*+* 历程III a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低 2.4
CH3OH(g) △H=-90.18kJmol-1 < O*+H*=OH*+* 历程III a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低 2.4
【解析】
(1)反应i-反应iii即可得CO、H2合成甲醇的热化学方程式;
(2)①根据图示△H=-0.75eV+0.37eV=-0.38eV<0;
②根据图示书写方程式;
③根据图示比较每一个过程的相对能量变化值大小;
(3)①根据平衡移动进行分析比较;
②设起始时n(CO2)=5mol,则n(H2)=15mol,根据图象,当CH4和CO平衡组成为40%时,则CO2平衡组成为20%,所以△n(CO)=5mol×40%=2mol,△n(CH4)=5mol×40%=2mol,则:反应ii:![]() ,
,
反应iii:![]() ,
,
求出平衡时各物质的物质的量,带入平衡常数K=![]() 进行计算。
进行计算。
(1)反应i反应iii即可得CO、H2合成甲醇的热化学方程式:CO(g)+2H2(g) =C H3OH(g),计算焓变:△H=49kJmol141.17kJmol1=90.17kJmol1;
故答案为:CO(g)+2H2(g) =C H3OH(g)△H=90.17kJmol1;
(2)①根据图示△H=0.75eV+0.37eV=0.38eV<0,故答案为:<;
②根据图示,反应历程Ⅱ方框内的方程式是:O+H=OH,故答案为:O+H=OH;
③根据图示,历程Ⅲ的过渡态Ⅲ相对能量最大,即活化能最大,所以历程Ⅲ是RWGS的控速步骤,故答案为:历程Ⅲ;
(3)①对于反应ii,升高温度,平衡逆移,CH4、H2O的百分含量减少,对于平衡iii,升高温度,则平衡正移,CO的百分含量增加;增大压强,反应ii,平衡正移,H2O的百分含量增大,使反应Ⅲ逆移,CO百分含量降低,,综上:CH4、CO的变化幅度相对较小,则表示CH4和CO平衡组成随温度变化关系的曲线分别是a、d;
故答案为:a;d;相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向动,使得CO平衡组分降低;
②设起始时n(CO2)=5mol,则n(H2)=15mol,根据图象,当CH4和CO平衡组成为40%时,则CO2平衡组成为20%,所以△n(CO)=5mol×40%=2mol,△n(CH4)=5mol×40%=2mol,则
反应ii:![]() ,
,
反应iii:![]()
平衡时:n(CO2)=(522)mol=1mol,n(H2)=(1582)mol=5mol,n(CO)=2mol,n(H2O)=(4+2)mol=6mol,平衡常数![]() ;
;
故答案为:2.4。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案