题目内容
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
【答案】BD 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O BC 称量操作简单宜行 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ![]()
【解析】
(1)A.根据合金的定义判断;
B.铜生成碱式碳酸铜,较为疏松;
C.铜与O2反应生成氧化铜,为黑色固体;
D.CuSO45H2O为纯净物。
(2)①铜与稀硝酸反应生成硝酸铜,NO和水;依据硝酸在反应中氮元素化合价变化判断硝酸表现的性质;
②铝为活泼金属,可与强酸,也可与强碱反应生成氢气,根据反应前后质量差可计算出Al的质量,利用Al与NaOH溶液反应方程式中Al与H2的物质的量关系可计算出氢气在标准状况下的体积。
(1)A.青铜是铜锡合金、不锈钢是铁铬、镍合金、硬铝是铝硅、镁等形成的合金,A正确;
B.铜生成碱式碳酸铜,较为疏松,B错误;
C.铜与O2反应生成氧化铜,为黑色固体,C正确;
D.CuSO45H2O为纯净物,加热后变为白色的固体CuSO4,D错误;
故合理选项是BD;
(2)①铜与稀硝酸反应生成Cu(NO3)2,NO和H2O,反应的离子方程式:3Cu+8H++NO3-=3Cu2++2NO↑+4H2O;反应中NO3-中N元素部分化合价降低,表现氧化性,部分化合价不变表现酸性,故合理选项是BC;
②测量气体的体积不如测量固体的质量简单易操作,所以方案Ⅱ比方案Ⅰ更易于实施,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
铜铝混合物质量是m1,反应后未反应的Cu的质量为m2,则反应的Al的质量m(Al)=(m1-m2)g,Al的物质的量为n(Al)=![]() mol,根据方程式中Al与H2的物质的量关系可知n(H2)=
mol,根据方程式中Al与H2的物质的量关系可知n(H2)=![]() n(Al)=
n(Al)=![]() mol=
mol=![]() mol,则反应产生的氢气在标准状况下的体积V(H2)=n·Vm=
mol,则反应产生的氢气在标准状况下的体积V(H2)=n·Vm=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。

【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
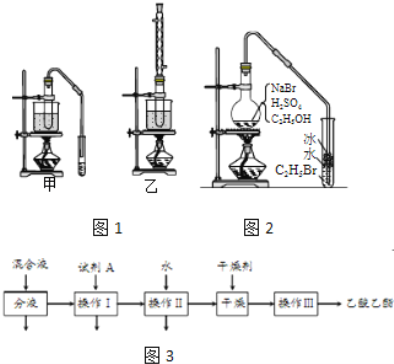
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
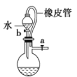
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.